Moleküler fizik ve termodinamik moleküler fizik ve. Moleküler fiziğin ve termodinamiğin temelleri
Görünüşe göre çok dolaylı olarak ilişkili olan doğada meydana gelen olaylar mekanik hareket. Cisimlerin sıcaklığı değiştiğinde veya maddeler bir durumdan (örneğin sıvı) başka bir duruma (katı veya gaz) geçtiğinde gözlemlenirler. Bu tür olaylara denir termal.
Termal olaylar insanların, hayvanların ve bitkilerin yaşamlarında büyük rol oynamaktadır. Sıcaklıktan çevre Dünyadaki yaşamın olasılığına bağlıdır. Mevsimsel sıcaklık değişiklikleri, canlı doğanın ritimlerini belirler - kışın bitki yaşamı donar, birçok hayvan kış uykusuna yatar. İlkbaharda doğa uyanır, çayırlar yeşerir, ağaçlar çiçek açar.
Sıcaklık değişiklikleri cisimlerin özelliklerini etkiler. Isıtıldığında ve soğutulduğunda sıvı ve gazların hacimleri ve boyutları değişir katılar.
Termal olaylar tabidir belirli kanunlar bilgisi, bu fenomenlerin teknolojide ve günlük yaşamda kullanılmasına izin verir. Modern ısı motorları, soğutma üniteleri, gaz boru hatları ve diğer cihazlar bu yasalara göre çalışır.
Moleküler fizik ve termodinamik
Moleküler fizik ve termodinamik oluşan sistemlerin davranışını incelemek büyük sayı parçacıklar.
TANIM
Moleküler fizik- inceleyen fizik dalı fiziksel özellikler moleküler yapıları dikkate alınarak çeşitli toplanma durumlarındaki cisimler.
Moleküler fizik, gazların, sıvıların, katıların yapısını ve özelliklerini, bunların karşılıklı dönüşümlerini, ayrıca dış koşullar değiştiğinde iç yapılarında ve davranışlarında meydana gelen değişiklikleri inceler.
TANIM
Termodinamik- Sistemde meydana gelen enerji dönüşümlerinin koşullarını ve niteliksel ilişkilerini analiz ederek etkileşim halindeki cisimlerden oluşan bir sistemin özelliklerini inceleyen bir fizik dalı.
Moleküler (veya istatistiksel) fizik ile termodinamik arasındaki fark, fiziğin bu iki dalının termal olaylarİle farklı noktalar vizyon ve çeşitli yöntemler kullanın.
Moleküler fizik, moleküler yapılarının ve bireysel moleküllerin birbirleriyle etkileşim mekanizmasının incelenmesine dayanarak vücutta çeşitli süreçlerin meydana geldiği yasaları belirler. Termodinamik, cisimlerin özelliklerini, içlerinde meydana gelen moleküler olayları hesaba katmadan inceler.
Moleküler fiziğin kullanım alanları istatistiksel yöntem Her molekülün ayrı ayrı hareketini ve etkileşimini değil, bir bütün olarak moleküllerin hareketini ve etkileşimini dikkate alan yaklaşım.
Termodinamiğin kullanım alanları termodinamik yöntem Tüm süreçleri enerji dönüşümü açısından ele alan. İstatistiksel yöntemden farklı olarak termodinamik yöntem, cisimlerin iç yapısı ve bu cisimleri oluşturan moleküllerin hareketinin doğası hakkında herhangi bir spesifik fikirle ilişkili değildir. Termodinamiğin yasaları, işi gerçekleştirmek için ısının en uygun şekilde kullanılmasının araştırılmasında ampirik olarak oluşturulmuştur.
ÖNSÖZ
Moleküler fizik ve termodinamik temel düzeyde incelenir genel konsept enerji ve onun dönüşümleri, maddenin özellikleri ve özellikleri hakkında farklı koşullar. Bu tür konuların ele alınması, genel teknik ve özel disiplinlerin geliştirilmesinin temelini oluşturur. Bir üniversite mezununun gelecekteki pratik faaliyetlerinde, bu bilgi ve beceriler, mühendislik problemlerini belirleme ve çözmenin yanı sıra yeni teknoloji ve ekipman türlerinde uzmanlaşmaya da yardımcı olmalıdır.
Buna uygun olarak, ders kitabı Termal olayları karakterize eden temel kavramlar ve nicelikler ile bunlar arasındaki ilişkiler tutarlı bir şekilde tanıtılmaktadır. Klasik istatistiğin özellikleri, Maxwell-Boltzmann dağılımı, taşınım olgusu, kuantum elektroniği ve plazma kavramı ve faz dönüşümleri ele alınmaktadır.
Birinci ve ikinci ilkelere dayanarak termodinamiğin temelleri ele alınır.
Metne ilgili konulardaki problem çözme örnekleri eşlik etmektedir.
Ekte fiziksel sabitler, bazı matematiksel ilişkiler, ayrıca kolokyumlar veya oturumlar yürütmek için sorular ve görevler yer almaktadır. bağımsız çalışmaöğrenciler.
Kuantum istatistikleri ve katı hal fiziği ile ilgili burada eksik olan materyal, daha önce yayınlanmış kılavuzumuzda mevcuttur (3).
Örneklerde standart olmayan birimler (cal, atm, mmHg, vb.) verilse de, kılavuz standart SI birim sistemini kullanmaktadır.
GİRİİŞ
MOLEKÜLER FİZİK VE TERMODİNAMİK
Moleküler fizikHerhangi bir cismin sürekli kaotik termal hareket halindeki çok sayıda parçacıktan (atom veya molekül) oluştuğuna dair deneyimlerden elde edilen kavramlara dayanarak, maddenin yapısını ve özelliklerini inceleyen bir fizik dalı. Mekanikte bir cismin hareketi, başlangıç koşulları ve cisme etki eden kuvvetler tarafından benzersiz bir şekilde belirlenir. Bu miktarları bilerek istediğiniz zaman vücudun konumunu hesaplayabilirsiniz. Bu tür olaylar dinamik yasalarla tanımlanır. Moleküler fizik, çok sayıda parçacığın eyleminin neden olduğu olaylarla ilgilenir. Koordinatları ve hızları sürekli değişen bu kadar çok sayıda parçacığın hareketiyle, çok sayıda atom veya molekülün her birinin hareketini bir bilgisayarda bile hesaplamak imkansızdır, bu nedenle bu durumda olasılıksal veya istatistiksel modeller, istatistiksel fizik yöntemleriyle incelenmiştir. Bu, moleküler fizik yasalarının mekanik yasalarına indirgenemeyeceği anlamına gelir. İstatistiksel fizikte belirli bir moleküler model dikkate alınır ve ona uygulanır. matematiksel yöntemler istatistik ve olasılık teorisi. Bu nedenle çalışmada istatistiksel yöntem kullanılmıştır.
İstatistiksel yöntemolasılık teorisi ve matematiksel istatistik yasalarına dayanmaktadır.
İstatistiksel fizik dikkate alır denge durumu - makroskobik parametrelerin zamanla değişmediği bir durumdur.
İstatistiksel fizik yöntemleri, örneğin difüzyon, termal iletkenlik, ısı kapasitesi - tamamen maddenin yapısı tarafından belirlenen olayları incelemek için kullanılır. Çok sayıda parçacıktan oluşan cisimlerdeki makroskobik süreçler de termodinamik tarafından incelenir.
Termodinamik- bağlantıları ve karşılıklı dönüşümleri inceleyen bir fizik dalı çeşitli türler enerji, ısı ve iş.
Termodinamik belirli moleküler modelleri dikkate almaz. Deneysel verilere dayanarak termodinamiğin temel yasaları veya ilkeleri formüle edilir. Bu yasalar ve sonuçları, makroskobik enerji dönüşümleriyle ilişkili belirli fiziksel olaylara uygulanır; tek tek atom ve moleküllerde meydana gelen süreçlerde değil, çok sayıda parçacıktan oluşan cisimlerde.
Dolayısıyla termodinamiğin ve istatistiksel fiziğin konusu aynıdır, sadece birbirini tamamlayan yöntemler farklıdır.
Termodinamik incelemeleri termodinamik sistemler. Sistem uzayın sonlu bir bölgesinde bulunan fiziksel nesnelerin koleksiyonuna denir. Termodinamik sistem birbirleriyle ve dış çevreyle enerji ve madde alışverişinde bulunan makroskobik cisimler ve alanların bir koleksiyonudur. Sistem tek gövdeden de oluşabilmektedir. Sistemi karakterize eden işaretler, örneğin basınç, sıcaklık, yoğunluk ve diğerleri, termodinamik parametreler veya durum parametreleri olarak adlandırılır. Tipik olarak sistemin durumunu tamamen tanımlayan minimum sayıda parametre seçilir.
Ayırt etmek yaygın değerleri madde miktarına bağlı olan parametreler ve yoğun değerleri madde miktarına bağlı olmayan parametreler. Kapsamlı bir niceliğe örnek olarak enerji, yoğun bir niceliğe ise yoğunluk ve sıcaklık verilebilir. Tipik olarak kapsamlı parametreler şunları belirtir: büyük harflerle ve yoğun - küçük harf.
Tüm termodinamik parametrelerin kümesi sistemin termodinamik durumunu belirler. Durum denklemi hem sistemin durumunu hem de diğer parametreleri tanımlamak için gerekli olan minimum sayıda termodinamik parametreyi birbirine bağlar. Termodinamik yöntem, bir termodinamik sistemin durumunun belirlenmesine dayanmaktadır.
İstatistiksel ve termodinamik yöntemler etkili yöntemler Sadece moleküler sistemler değil, çok sayıda parçacıktan oluşan herhangi bir sistemin incelenmesi. Bu, bu yöntemlerin genel fiziksel araştırma yöntemleri olduğu ve moleküler fiziğin bunların uygulama alanlarından yalnızca biri olduğu anlamına gelir.
 Moleküler fizik ve termodinamik, yaklaşımları bakımından aslında iki farklı, ancak aynı şeyle ilgilenen, birbiriyle yakından ilişkili bilimlerdir; fiziksel sistemlerin makroskobik özelliklerinin incelenmesi, ancak tamamen farklı yöntemlerle.
Moleküler fizik ve termodinamik, yaklaşımları bakımından aslında iki farklı, ancak aynı şeyle ilgilenen, birbiriyle yakından ilişkili bilimlerdir; fiziksel sistemlerin makroskobik özelliklerinin incelenmesi, ancak tamamen farklı yöntemlerle.
 Moleküler fizik Moleküler fizik veya moleküler kinetik teori, maddenin yapısı hakkındaki belirli fikirlere dayanmaktadır. – Çok sayıda parçacıktan oluşan makroskobik sistemlerin davranış yasalarını oluşturmak için moleküler fizik, örneğin ideal gaz modelleri gibi çeşitli madde modellerini kullanır. Moleküler fizik istatistiksel teori, fizik, yani olasılıksal modellere dayanarak çok sayıda parçacıktan (atomlar, moleküller) oluşan sistemlerin davranışını dikkate alan bir teori. İstatistiksel bir yaklaşıma dayalı olarak, deneysel olarak ölçülen makroskobik büyüklükler (basınç, hacim, sıcaklık vb.) ile sistemin mikroskobik özelliklerinde yer alan parçacıkların mikroskobik özellikleri (kütle, momentum, enerji vb.) arasında bir bağlantı kurmayı amaçlar. .) .
Moleküler fizik Moleküler fizik veya moleküler kinetik teori, maddenin yapısı hakkındaki belirli fikirlere dayanmaktadır. – Çok sayıda parçacıktan oluşan makroskobik sistemlerin davranış yasalarını oluşturmak için moleküler fizik, örneğin ideal gaz modelleri gibi çeşitli madde modellerini kullanır. Moleküler fizik istatistiksel teori, fizik, yani olasılıksal modellere dayanarak çok sayıda parçacıktan (atomlar, moleküller) oluşan sistemlerin davranışını dikkate alan bir teori. İstatistiksel bir yaklaşıma dayalı olarak, deneysel olarak ölçülen makroskobik büyüklükler (basınç, hacim, sıcaklık vb.) ile sistemin mikroskobik özelliklerinde yer alan parçacıkların mikroskobik özellikleri (kütle, momentum, enerji vb.) arasında bir bağlantı kurmayı amaçlar. .) .
 Termodinamik Moleküler kinetik teoriden farklı olarak termodinamik, makroskobik sistemlerin termodinamik özelliklerini incelerken maddenin moleküler yapısı hakkındaki herhangi bir fikre dayanmaz. Termodinamik fenomenolojik bir bilimdir. – Enerjinin korunumu yasası gibi deneyimle oluşturulan yasalara dayanarak maddenin özellikleri hakkında sonuçlar çıkarır. Termodinamik yalnızca fiziksel deneylere dayanarak ortaya konan makroskobik büyüklüklerle (basınç, sıcaklık, hacim vb.) çalışır.
Termodinamik Moleküler kinetik teoriden farklı olarak termodinamik, makroskobik sistemlerin termodinamik özelliklerini incelerken maddenin moleküler yapısı hakkındaki herhangi bir fikre dayanmaz. Termodinamik fenomenolojik bir bilimdir. – Enerjinin korunumu yasası gibi deneyimle oluşturulan yasalara dayanarak maddenin özellikleri hakkında sonuçlar çıkarır. Termodinamik yalnızca fiziksel deneylere dayanarak ortaya konan makroskobik büyüklüklerle (basınç, sıcaklık, hacim vb.) çalışır.
 Her iki yaklaşım da (termodinamik ve istatistiksel) çelişmez, aksine birbirini tamamlar. Yalnızca termodinamik ve moleküler kinetik teorinin birlikte kullanılması, çok sayıda parçacıktan oluşan sistemlerin özelliklerinin en eksiksiz şekilde anlaşılmasını sağlayabilir.
Her iki yaklaşım da (termodinamik ve istatistiksel) çelişmez, aksine birbirini tamamlar. Yalnızca termodinamik ve moleküler kinetik teorinin birlikte kullanılması, çok sayıda parçacıktan oluşan sistemlerin özelliklerinin en eksiksiz şekilde anlaşılmasını sağlayabilir.
 Moleküler fizik Moleküler kinetik teorisi, kimyasal maddelerin en küçük parçacıkları olarak atomların ve moleküllerin varlığı fikrine dayanarak maddenin yapısı ve özelliklerinin incelenmesidir.
Moleküler fizik Moleküler kinetik teorisi, kimyasal maddelerin en küçük parçacıkları olarak atomların ve moleküllerin varlığı fikrine dayanarak maddenin yapısı ve özelliklerinin incelenmesidir.
 Moleküler-kinetik teori MKT'nin temel prensipleri 1. Sıvı, katı ve gaz halindeki tüm maddeler, kendileri de atomlardan ("temel moleküller") oluşan en küçük parçacıklardan - moleküllerden oluşur. Moleküller kimyasal madde basit veya karmaşık olabilir, yani bir veya daha fazla atomdan oluşabilir. Moleküller ve atomlar elektriksel olarak nötr parçacıklardır. Belirli koşullar altında moleküller ve atomlar ek elektrik yükü kazanabilir ve pozitif veya negatif iyonlar haline gelebilir. 2. Atomlar ve moleküller, termal hareket adı verilen sürekli kaotik bir hareket halindedir. 3. Parçacıklar birbirleriyle doğası gereği elektriksel kuvvetlerle etkileşime girer. Parçacıklar arasındaki çekimsel etkileşim ihmal edilebilir düzeydedir.
Moleküler-kinetik teori MKT'nin temel prensipleri 1. Sıvı, katı ve gaz halindeki tüm maddeler, kendileri de atomlardan ("temel moleküller") oluşan en küçük parçacıklardan - moleküllerden oluşur. Moleküller kimyasal madde basit veya karmaşık olabilir, yani bir veya daha fazla atomdan oluşabilir. Moleküller ve atomlar elektriksel olarak nötr parçacıklardır. Belirli koşullar altında moleküller ve atomlar ek elektrik yükü kazanabilir ve pozitif veya negatif iyonlar haline gelebilir. 2. Atomlar ve moleküller, termal hareket adı verilen sürekli kaotik bir hareket halindedir. 3. Parçacıklar birbirleriyle doğası gereği elektriksel kuvvetlerle etkileşime girer. Parçacıklar arasındaki çekimsel etkileşim ihmal edilebilir düzeydedir.
 Moleküler-kinetik teori Moleküler-kinetik teorinin atomların ve moleküllerin rastgele hareketi hakkındaki fikirlerinin en çarpıcı deneysel doğrulaması Brown hareketidir. Brown hareketi, bir sıvı veya gaz içinde asılı duran küçük mikroskobik parçacıkların termal hareketidir. 1827 yılında İngiliz botanikçi R. Brown tarafından keşfedilmiştir. Brown parçacıkları moleküllerin rastgele etkilerinin etkisi altında hareket eder. Moleküllerin kaotik termal hareketi nedeniyle bu etkiler asla birbirini iptal etmez. Sonuç olarak, Brown parçacığının hızı büyüklük ve yön açısından rastgele değişir ve yörüngesi karmaşık bir zikzak eğrisidir (Şekil). Brown hareketi teorisi, 1905 yılında A. Einstein tarafından oluşturuldu. Einstein'ın teorisi, 1908-1911'de Fransız fizikçi J. Perrin'in deneylerinde deneysel olarak doğrulandı.
Moleküler-kinetik teori Moleküler-kinetik teorinin atomların ve moleküllerin rastgele hareketi hakkındaki fikirlerinin en çarpıcı deneysel doğrulaması Brown hareketidir. Brown hareketi, bir sıvı veya gaz içinde asılı duran küçük mikroskobik parçacıkların termal hareketidir. 1827 yılında İngiliz botanikçi R. Brown tarafından keşfedilmiştir. Brown parçacıkları moleküllerin rastgele etkilerinin etkisi altında hareket eder. Moleküllerin kaotik termal hareketi nedeniyle bu etkiler asla birbirini iptal etmez. Sonuç olarak, Brown parçacığının hızı büyüklük ve yön açısından rastgele değişir ve yörüngesi karmaşık bir zikzak eğrisidir (Şekil). Brown hareketi teorisi, 1905 yılında A. Einstein tarafından oluşturuldu. Einstein'ın teorisi, 1908-1911'de Fransız fizikçi J. Perrin'in deneylerinde deneysel olarak doğrulandı.
 Moleküler kinetik teori Bir maddenin moleküllerinin sürekli kaotik hareketi, kolayca gözlemlenebilen başka bir olayda da kendini gösterir: difüzyon. Difüzyon, iki veya daha fazla temas eden maddenin birbirine nüfuz etmesi olgusudur. – Bileşimi heterojen ise, gazda işlem en hızlı şekilde ilerler. Difüzyon oluşumuna yol açar homojen karışım bileşenlerin yoğunluğundan bağımsız olarak. Dolayısıyla, kabın bir bölmeyle ayrılmış iki kısmında oksijen O2 ve hidrojen H2 varsa, bölmeyi çıkardıktan sonra, birbirlerinin gazlarının birbirine nüfuz etme süreci başlar ve bu da patlayıcı bir karışımın oluşumuna yol açar - patlayıcı gaz. Bu işlem aynı zamanda kabın üst yarısında hafif bir gaz (hidrojen) ve alt yarısında daha ağır bir gaz (oksijen) olduğunda da meydana gelir.
Moleküler kinetik teori Bir maddenin moleküllerinin sürekli kaotik hareketi, kolayca gözlemlenebilen başka bir olayda da kendini gösterir: difüzyon. Difüzyon, iki veya daha fazla temas eden maddenin birbirine nüfuz etmesi olgusudur. – Bileşimi heterojen ise, gazda işlem en hızlı şekilde ilerler. Difüzyon oluşumuna yol açar homojen karışım bileşenlerin yoğunluğundan bağımsız olarak. Dolayısıyla, kabın bir bölmeyle ayrılmış iki kısmında oksijen O2 ve hidrojen H2 varsa, bölmeyi çıkardıktan sonra, birbirlerinin gazlarının birbirine nüfuz etme süreci başlar ve bu da patlayıcı bir karışımın oluşumuna yol açar - patlayıcı gaz. Bu işlem aynı zamanda kabın üst yarısında hafif bir gaz (hidrojen) ve alt yarısında daha ağır bir gaz (oksijen) olduğunda da meydana gelir.
 Moleküler kinetik teori: Benzer süreçler sıvılarda çok daha yavaş gerçekleşir. Birbirine benzemeyen iki sıvının birbirine nüfuz etmesi, katıların sıvılarda çözünmesi (örneğin su içinde şeker) ve homojen çözeltilerin oluşması sıvılarda difüzyon işlemlerine örnektir. Gerçek koşullarda, sıvı ve gazlardaki difüzyon, örneğin konveksiyon akımlarının oluşması nedeniyle daha hızlı karıştırma işlemleriyle maskelenir.
Moleküler kinetik teori: Benzer süreçler sıvılarda çok daha yavaş gerçekleşir. Birbirine benzemeyen iki sıvının birbirine nüfuz etmesi, katıların sıvılarda çözünmesi (örneğin su içinde şeker) ve homojen çözeltilerin oluşması sıvılarda difüzyon işlemlerine örnektir. Gerçek koşullarda, sıvı ve gazlardaki difüzyon, örneğin konveksiyon akımlarının oluşması nedeniyle daha hızlı karıştırma işlemleriyle maskelenir.
 Moleküler kinetik teori - Difüzyon süreci katılarda en yavaş gerçekleşir. Ancak deneyler, katı cisimlerin iki metalin iyi temizlenmiş yüzeyleri ile temas etmesi durumunda, uzun bir süre sonra diğer metalin atomlarının her birinde bulunduğunu göstermektedir. Difüzyon ve Brown hareketi - Difüzyon ve Brown hareketi birbiriyle ilişkili olaylardır. Temas eden maddelerin birbirine nüfuz etmesi ve bir sıvı veya gaz içinde asılı duran küçük parçacıkların rastgele hareketi, moleküllerin kaotik termal hareketinin bir sonucu olarak ortaya çıkar.
Moleküler kinetik teori - Difüzyon süreci katılarda en yavaş gerçekleşir. Ancak deneyler, katı cisimlerin iki metalin iyi temizlenmiş yüzeyleri ile temas etmesi durumunda, uzun bir süre sonra diğer metalin atomlarının her birinde bulunduğunu göstermektedir. Difüzyon ve Brown hareketi - Difüzyon ve Brown hareketi birbiriyle ilişkili olaylardır. Temas eden maddelerin birbirine nüfuz etmesi ve bir sıvı veya gaz içinde asılı duran küçük parçacıkların rastgele hareketi, moleküllerin kaotik termal hareketinin bir sonucu olarak ortaya çıkar.
 Moleküler kinetik teorisi İki molekül arasında etki eden kuvvetler İki molekül arasında etki eden kuvvetler, aralarındaki mesafeye bağlıdır. Moleküller hem pozitif hem de negatif yükler içeren karmaşık uzaysal yapılardır. Moleküller arasındaki mesafe yeterince büyükse, moleküller arası çekim kuvvetleri baskın olur. Kısa mesafelerde itici kuvvetler baskındır.
Moleküler kinetik teorisi İki molekül arasında etki eden kuvvetler İki molekül arasında etki eden kuvvetler, aralarındaki mesafeye bağlıdır. Moleküller hem pozitif hem de negatif yükler içeren karmaşık uzaysal yapılardır. Moleküller arasındaki mesafe yeterince büyükse, moleküller arası çekim kuvvetleri baskın olur. Kısa mesafelerde itici kuvvetler baskındır.
 Moleküler kinetik teori Belirli bir mesafede r = r 0 etkileşim kuvveti sıfır olur. Bu mesafe geleneksel olarak molekülün çapı olarak alınabilir. r = r 0 anında etkileşimin potansiyel enerjisi minimumdur. Birbirinden r 0 mesafede bulunan iki molekülü çıkarmak için onlara ek enerji E 0 vermeniz gerekir. E 0 miktarına potansiyel kuyunun derinliği veya bağlanma enerjisi denir. Moleküllerin boyutu son derece küçüktür. Basit tek atomlu moleküller 10-10 m mertebesinde bir boyuta sahiptir. Karmaşık çok atomlu moleküller ise yüzlerce ve binlerce kat daha büyük boyutlara sahip olabilir.
Moleküler kinetik teori Belirli bir mesafede r = r 0 etkileşim kuvveti sıfır olur. Bu mesafe geleneksel olarak molekülün çapı olarak alınabilir. r = r 0 anında etkileşimin potansiyel enerjisi minimumdur. Birbirinden r 0 mesafede bulunan iki molekülü çıkarmak için onlara ek enerji E 0 vermeniz gerekir. E 0 miktarına potansiyel kuyunun derinliği veya bağlanma enerjisi denir. Moleküllerin boyutu son derece küçüktür. Basit tek atomlu moleküller 10-10 m mertebesinde bir boyuta sahiptir. Karmaşık çok atomlu moleküller ise yüzlerce ve binlerce kat daha büyük boyutlara sahip olabilir.
 Moleküler kinetik teori Termal hareketin kinetik enerjisi artan sıcaklıkla artar. Düşük sıcaklıklarda, bir molekülün ortalama kinetik enerjisi E0 potansiyel kuyusunun derinliğinden daha az olabilir. Bu durumda moleküller sıvıya veya sıvıya yoğunlaşır. sağlam; bu durumda moleküller arasındaki ortalama mesafe yaklaşık olarak r 0'a eşit olacaktır. Sıcaklık arttıkça molekülün ortalama kinetik enerjisi E 0'dan büyük olur, moleküller birbirinden ayrılır ve gaz halinde bir madde oluşur.
Moleküler kinetik teori Termal hareketin kinetik enerjisi artan sıcaklıkla artar. Düşük sıcaklıklarda, bir molekülün ortalama kinetik enerjisi E0 potansiyel kuyusunun derinliğinden daha az olabilir. Bu durumda moleküller sıvıya veya sıvıya yoğunlaşır. sağlam; bu durumda moleküller arasındaki ortalama mesafe yaklaşık olarak r 0'a eşit olacaktır. Sıcaklık arttıkça molekülün ortalama kinetik enerjisi E 0'dan büyük olur, moleküller birbirinden ayrılır ve gaz halinde bir madde oluşur.
 Moleküler kinetik teorisi Eyaletleri birleştir maddeler Katılarda moleküller sabit merkezler (denge konumları) etrafında rastgele titreşimlere maruz kalırlar. Bu merkezler uzayda düzensiz bir şekilde yerleşebilir (amorf cisimler) veya düzenli hacimsel yapılar (kristal cisimler) oluşturabilir. Bu nedenle katılar hem şeklini hem de hacmini korur
Moleküler kinetik teorisi Eyaletleri birleştir maddeler Katılarda moleküller sabit merkezler (denge konumları) etrafında rastgele titreşimlere maruz kalırlar. Bu merkezler uzayda düzensiz bir şekilde yerleşebilir (amorf cisimler) veya düzenli hacimsel yapılar (kristal cisimler) oluşturabilir. Bu nedenle katılar hem şeklini hem de hacmini korur
 Moleküler kinetik teorisi Maddenin toplu halleri Sıvılarda moleküller termal hareket için çok daha fazla özgürlüğe sahiptir. Belirli merkezlere bağlı değildirler ve hacmin tamamı boyunca hareket edebilirler. Bu, sıvıların akışkanlığını açıklar. Yakın konumdaki sıvı moleküller aynı zamanda birden fazla molekül içeren düzenli yapılar da oluşturabilir. Bu olaya, kristal cisimlerin uzun menzilli düzen özelliğinin aksine, kısa menzilli düzen adı verilir. Bu nedenle sıvılar şekillerini değil hacimlerini korurlar.
Moleküler kinetik teorisi Maddenin toplu halleri Sıvılarda moleküller termal hareket için çok daha fazla özgürlüğe sahiptir. Belirli merkezlere bağlı değildirler ve hacmin tamamı boyunca hareket edebilirler. Bu, sıvıların akışkanlığını açıklar. Yakın konumdaki sıvı moleküller aynı zamanda birden fazla molekül içeren düzenli yapılar da oluşturabilir. Bu olaya, kristal cisimlerin uzun menzilli düzen özelliğinin aksine, kısa menzilli düzen adı verilir. Bu nedenle sıvılar şekillerini değil hacimlerini korurlar.
 Moleküler kinetik teorisi Maddenin toplu halleri Gazlarda, moleküller arasındaki mesafeler genellikle boyutlarından çok daha büyüktür. Bu kadar büyük mesafelerdeki moleküller arasındaki etkileşim kuvvetleri küçüktür ve her molekül, başka bir molekülle veya kabın duvarı ile bir sonraki çarpışmaya kadar düz bir çizgi boyunca hareket eder. – Normal koşullar altında hava molekülleri arasındaki ortalama mesafe yaklaşık 10-8 m'dir, yani moleküllerin boyutunun onlarca katıdır. Moleküller arasındaki zayıf etkileşim, gazların genişleyip kabın tüm hacmini doldurma yeteneğini açıklar. Limitte etkileşim sıfıra yaklaştığında ideal gaz fikrine ulaşırız. Bu nedenle gazlar ne şeklini ne de hacmini korur
Moleküler kinetik teorisi Maddenin toplu halleri Gazlarda, moleküller arasındaki mesafeler genellikle boyutlarından çok daha büyüktür. Bu kadar büyük mesafelerdeki moleküller arasındaki etkileşim kuvvetleri küçüktür ve her molekül, başka bir molekülle veya kabın duvarı ile bir sonraki çarpışmaya kadar düz bir çizgi boyunca hareket eder. – Normal koşullar altında hava molekülleri arasındaki ortalama mesafe yaklaşık 10-8 m'dir, yani moleküllerin boyutunun onlarca katıdır. Moleküller arasındaki zayıf etkileşim, gazların genişleyip kabın tüm hacmini doldurma yeteneğini açıklar. Limitte etkileşim sıfıra yaklaştığında ideal gaz fikrine ulaşırız. Bu nedenle gazlar ne şeklini ne de hacmini korur
 Moleküler-kinetik teori Madde miktarı Moleküler-kinetik teoride, madde miktarının parçacıklardaki madde sayısıyla orantılı olduğu kabul edilir. Bir maddenin miktar birimine mol (mol) denir. Bir mol, 0,012 kg karbon 12 C atomuyla aynı sayıda parçacık (molekül) içeren bir madde miktarıdır. (Bir karbon molekülü bir atomdan oluşur) Dolayısıyla, herhangi bir maddenin bir molü aynı sayıda atom içerir. parçacıklar (moleküller). Bu sayıya Avogadro sabiti NA denir: NA = 6,02·1023 mol–1 Avogadro sabiti moleküler kinetik teorisindeki en önemli sabitlerden biridir.
Moleküler-kinetik teori Madde miktarı Moleküler-kinetik teoride, madde miktarının parçacıklardaki madde sayısıyla orantılı olduğu kabul edilir. Bir maddenin miktar birimine mol (mol) denir. Bir mol, 0,012 kg karbon 12 C atomuyla aynı sayıda parçacık (molekül) içeren bir madde miktarıdır. (Bir karbon molekülü bir atomdan oluşur) Dolayısıyla, herhangi bir maddenin bir molü aynı sayıda atom içerir. parçacıklar (moleküller). Bu sayıya Avogadro sabiti NA denir: NA = 6,02·1023 mol–1 Avogadro sabiti moleküler kinetik teorisindeki en önemli sabitlerden biridir.
 Moleküler-kinetik teori Bir ν maddesinin miktarı, bir maddenin parçacık (molekül) sayısının N'nin Avogadro sabiti NА'ye oranı olarak tanımlanır: Bir maddenin bir molünün kütlesine genellikle molar kütle M denir. Molar kütle belirli bir maddenin bir molekülünün m 0 kütlesinin Avogadro sabiti ile çarpımına eşittir: M = NA · m 0 Molar kütle, mol başına kilogram (kg/mol) cinsinden ifade edilir. Molekülleri tek bir atomdan oluşan maddeler için sıklıkla atom kütlesi terimi kullanılır. Atom ve moleküllerin kütle birimi, karbon izotopu 12 C'nin (kütle numarası 12 olan) bir atomunun kütlesinin 1/12'si olarak alınır. Bu birime denir atom birimi kütle (a.u.m.): 1 a. e.m. = 1,66·10–27 kg. Bu değer neredeyse bir proton veya nötronun kütlesine denk gelmektedir. Belirli bir maddenin bir atomunun veya molekülünün kütlesinin, bir karbon atomu 12C kütlesinin 1/12'sine oranına bağıl kütle denir.
Moleküler-kinetik teori Bir ν maddesinin miktarı, bir maddenin parçacık (molekül) sayısının N'nin Avogadro sabiti NА'ye oranı olarak tanımlanır: Bir maddenin bir molünün kütlesine genellikle molar kütle M denir. Molar kütle belirli bir maddenin bir molekülünün m 0 kütlesinin Avogadro sabiti ile çarpımına eşittir: M = NA · m 0 Molar kütle, mol başına kilogram (kg/mol) cinsinden ifade edilir. Molekülleri tek bir atomdan oluşan maddeler için sıklıkla atom kütlesi terimi kullanılır. Atom ve moleküllerin kütle birimi, karbon izotopu 12 C'nin (kütle numarası 12 olan) bir atomunun kütlesinin 1/12'si olarak alınır. Bu birime denir atom birimi kütle (a.u.m.): 1 a. e.m. = 1,66·10–27 kg. Bu değer neredeyse bir proton veya nötronun kütlesine denk gelmektedir. Belirli bir maddenin bir atomunun veya molekülünün kütlesinin, bir karbon atomu 12C kütlesinin 1/12'sine oranına bağıl kütle denir.
 Moleküler kinetik teori Moleküler kinetik teorinin dikkate aldığı en basit model ideal gaz modelidir: 1. İdeal bir gazın kinetik modelinde, moleküller 1. birbirleriyle ve duvarlarla yalnızca elastiklik sırasında etkileşime giren ideal elastik toplar olarak kabul edilir. çarpışmalar. 2. Tüm moleküllerin toplam hacminin, gazın bulunduğu kabın hacmiyle karşılaştırıldığında küçük olduğu varsayılır. İdeal gaz modeli, gerçek gazların geniş bir basınç ve sıcaklık aralığındaki davranışını oldukça iyi tanımlar. Moleküler kinetik teorinin görevi mikroskobik (kütle, mikroskobik hız, moleküllerin kinetik enerjisi) ve makroskobik parametreler (basınç, hacim, makroskobik parametreler sıcaklık) arasında bir bağlantı kurmaktır.
Moleküler kinetik teori Moleküler kinetik teorinin dikkate aldığı en basit model ideal gaz modelidir: 1. İdeal bir gazın kinetik modelinde, moleküller 1. birbirleriyle ve duvarlarla yalnızca elastiklik sırasında etkileşime giren ideal elastik toplar olarak kabul edilir. çarpışmalar. 2. Tüm moleküllerin toplam hacminin, gazın bulunduğu kabın hacmiyle karşılaştırıldığında küçük olduğu varsayılır. İdeal gaz modeli, gerçek gazların geniş bir basınç ve sıcaklık aralığındaki davranışını oldukça iyi tanımlar. Moleküler kinetik teorinin görevi mikroskobik (kütle, mikroskobik hız, moleküllerin kinetik enerjisi) ve makroskobik parametreler (basınç, hacim, makroskobik parametreler sıcaklık) arasında bir bağlantı kurmaktır.
 Moleküler-kinetik teori Moleküllerin ve moleküllerin duvarlarla çarpışması sonucunda moleküllerin hızlarının büyüklüğü ve yönü değişebilir; Ardışık çarpışmalar arasındaki zaman aralıklarında moleküller düzgün ve doğrusal olarak hareket eder. İdeal gaz modelinde tüm çarpışmaların elastik çarpma kanunlarına göre meydana geldiği, yani Newton mekaniği kanunlarına uydukları varsayılır. İdeal gaz modelini kullanarak kabın duvarındaki gaz basıncını hesaplıyoruz. Bir molekülün kabın duvarı ile etkileşimi sırasında aralarında Newton'un üçüncü yasasına uyan kuvvetler ortaya çıkar. Sonuç olarak, molekülün duvara dik olan hızının υx izdüşümünün işareti ters yönde değişir ve duvara paralel hızın υy izdüşümü değişmeden kalır (Şekil).
Moleküler-kinetik teori Moleküllerin ve moleküllerin duvarlarla çarpışması sonucunda moleküllerin hızlarının büyüklüğü ve yönü değişebilir; Ardışık çarpışmalar arasındaki zaman aralıklarında moleküller düzgün ve doğrusal olarak hareket eder. İdeal gaz modelinde tüm çarpışmaların elastik çarpma kanunlarına göre meydana geldiği, yani Newton mekaniği kanunlarına uydukları varsayılır. İdeal gaz modelini kullanarak kabın duvarındaki gaz basıncını hesaplıyoruz. Bir molekülün kabın duvarı ile etkileşimi sırasında aralarında Newton'un üçüncü yasasına uyan kuvvetler ortaya çıkar. Sonuç olarak, molekülün duvara dik olan hızının υx izdüşümünün işareti ters yönde değişir ve duvara paralel hızın υy izdüşümü değişmeden kalır (Şekil).
 Moleküler-kinetik teori Bir kabın duvarındaki ortalama gaz basıncı formülü şu şekilde yazılacaktır: Bu denklem ideal bir gazın basıncı p, bir molekülün kütlesi m 0, moleküllerin konsantrasyonu n arasındaki ilişkiyi kurar. , hızın karesinin ortalama değeri ve moleküllerin öteleme hareketinin ortalama kinetik enerjisi. Bu, gazların moleküler kinetik teorisinin temel denklemidir. Dolayısıyla, gaz basıncı, birim hacimde bulunan moleküllerin öteleme hareketinin ortalama kinetik enerjisinin üçte ikisine eşittir.
Moleküler-kinetik teori Bir kabın duvarındaki ortalama gaz basıncı formülü şu şekilde yazılacaktır: Bu denklem ideal bir gazın basıncı p, bir molekülün kütlesi m 0, moleküllerin konsantrasyonu n arasındaki ilişkiyi kurar. , hızın karesinin ortalama değeri ve moleküllerin öteleme hareketinin ortalama kinetik enerjisi. Bu, gazların moleküler kinetik teorisinin temel denklemidir. Dolayısıyla, gaz basıncı, birim hacimde bulunan moleküllerin öteleme hareketinin ortalama kinetik enerjisinin üçte ikisine eşittir.
 Moleküler-kinetik teori Gazların MKT'sinin temel denklemi, n moleküllerinin konsantrasyonunun öteleme hareketinin ortalama kinetik enerjisi ile çarpımını içerir. Bu durumda basınç ortalama kinetik enerjiyle orantılıdır. Sorular ortaya çıkıyor: Sabit hacimli bir kaptaki moleküllerin ortalama kinetik hareket enerjisini deneysel olarak nasıl değiştirebiliriz? Ortalama kinetik enerjinin değişmesi için hangi fiziksel niceliğin değişmesi gerekir? Deneyimler böyle bir miktarın sıcaklık olduğunu göstermektedir.
Moleküler-kinetik teori Gazların MKT'sinin temel denklemi, n moleküllerinin konsantrasyonunun öteleme hareketinin ortalama kinetik enerjisi ile çarpımını içerir. Bu durumda basınç ortalama kinetik enerjiyle orantılıdır. Sorular ortaya çıkıyor: Sabit hacimli bir kaptaki moleküllerin ortalama kinetik hareket enerjisini deneysel olarak nasıl değiştirebiliriz? Ortalama kinetik enerjinin değişmesi için hangi fiziksel niceliğin değişmesi gerekir? Deneyimler böyle bir miktarın sıcaklık olduğunu göstermektedir.
 Moleküler kinetik teorisi Sıcaklık Sıcaklık kavramı, termal denge kavramıyla yakından ilgilidir. Birbirleriyle temas halinde olan cisimler enerji alışverişinde bulunabilirler. Termal temas sırasında bir cisim tarafından diğerine aktarılan enerjiye ısı miktarı Q denir. Termal denge, bir vücuttan diğerine ısı transferinin olmadığı termal temas halindeki cisimler sisteminin bir durumudur ve tüm makroskopik parametreler bedenler değişmeden kalır. Sıcaklık, termal dengedeki tüm cisimler için aynı olan fiziksel bir parametredir. Sıcaklık kavramını tanıtma olasılığı deneyimlerden kaynaklanmaktadır ve termodinamiğin sıfırıncı yasası olarak adlandırılmaktadır.
Moleküler kinetik teorisi Sıcaklık Sıcaklık kavramı, termal denge kavramıyla yakından ilgilidir. Birbirleriyle temas halinde olan cisimler enerji alışverişinde bulunabilirler. Termal temas sırasında bir cisim tarafından diğerine aktarılan enerjiye ısı miktarı Q denir. Termal denge, bir vücuttan diğerine ısı transferinin olmadığı termal temas halindeki cisimler sisteminin bir durumudur ve tüm makroskopik parametreler bedenler değişmeden kalır. Sıcaklık, termal dengedeki tüm cisimler için aynı olan fiziksel bir parametredir. Sıcaklık kavramını tanıtma olasılığı deneyimlerden kaynaklanmaktadır ve termodinamiğin sıfırıncı yasası olarak adlandırılmaktadır.
 Moleküler-kinetik teori Sıcaklık Sıcaklığı ölçmek için fiziksel aletler kullanılır - sıcaklık değerinin herhangi bir fiziksel parametredeki değişiklikle değerlendirildiği termometreler. Bir termometre oluşturmak için, bir termometrik madde (örneğin, cıva, alkol) ve maddenin özelliğini karakterize eden bir termometrik miktar (örneğin, bir cıva veya alkol sütununun uzunluğu) seçmelisiniz. Çeşitli termometre tasarımları, bir maddenin çeşitli fiziksel özelliklerini kullanır (örneğin, katıların doğrusal boyutlarında bir değişiklik veya ısıtıldığında iletkenlerin elektrik direncinde bir değişiklik). Termometreler kalibre edilmelidir.
Moleküler-kinetik teori Sıcaklık Sıcaklığı ölçmek için fiziksel aletler kullanılır - sıcaklık değerinin herhangi bir fiziksel parametredeki değişiklikle değerlendirildiği termometreler. Bir termometre oluşturmak için, bir termometrik madde (örneğin, cıva, alkol) ve maddenin özelliğini karakterize eden bir termometrik miktar (örneğin, bir cıva veya alkol sütununun uzunluğu) seçmelisiniz. Çeşitli termometre tasarımları, bir maddenin çeşitli fiziksel özelliklerini kullanır (örneğin, katıların doğrusal boyutlarında bir değişiklik veya ısıtıldığında iletkenlerin elektrik direncinde bir değişiklik). Termometreler kalibre edilmelidir.
 Moleküler-kinetik teori Fizikte özel bir yer, termometrik maddenin sabit hacimli bir kapta (V = sabit) seyreltilmiş bir gaz (helyum, hava) olduğu ve termometrik miktarın olduğu gaz termometreleri (Şek.) tarafından işgal edilmiştir. gaz basıncı p. Deneyimler, Celsius ölçeğinde ölçülen gaz basıncının (V = sabitte) artan sıcaklıkla arttığını göstermektedir.
Moleküler-kinetik teori Fizikte özel bir yer, termometrik maddenin sabit hacimli bir kapta (V = sabit) seyreltilmiş bir gaz (helyum, hava) olduğu ve termometrik miktarın olduğu gaz termometreleri (Şek.) tarafından işgal edilmiştir. gaz basıncı p. Deneyimler, Celsius ölçeğinde ölçülen gaz basıncının (V = sabitte) artan sıcaklıkla arttığını göstermektedir.
 Moleküler kinetik teori Sabit hacimli bir gaz termometresini kalibre etmek için, iki sıcaklıktaki (örneğin, 0 °C ve 100 °C) basıncı ölçebilir, grafik üzerinde p 0 ve p 100 noktalarını çizebilir ve ardından bir düz çizebilirsiniz. aralarındaki çizgi (Şek. ). Bu şekilde elde edilen kalibrasyon eğrisi kullanılarak diğer basınç değerlerine karşılık gelen sıcaklıklar belirlenebilir. Grafiği düşük basınç bölgesine göre tahmin ederek, gaz basıncının sıfır olacağı belirli bir "varsayımsal" sıcaklığı belirlemek mümkündür. Deneyimler bu sıcaklığın -273,15 °C olduğunu ve gazın özelliklerine bağlı olmadığını göstermektedir. Deneysel olarak, soğutma yoluyla sıfır basınçta bir gaz elde etmek imkansızdır çünkü çok düşük sıcaklıklarda tüm gazlar sıvı veya katı duruma dönüşür.
Moleküler kinetik teori Sabit hacimli bir gaz termometresini kalibre etmek için, iki sıcaklıktaki (örneğin, 0 °C ve 100 °C) basıncı ölçebilir, grafik üzerinde p 0 ve p 100 noktalarını çizebilir ve ardından bir düz çizebilirsiniz. aralarındaki çizgi (Şek. ). Bu şekilde elde edilen kalibrasyon eğrisi kullanılarak diğer basınç değerlerine karşılık gelen sıcaklıklar belirlenebilir. Grafiği düşük basınç bölgesine göre tahmin ederek, gaz basıncının sıfır olacağı belirli bir "varsayımsal" sıcaklığı belirlemek mümkündür. Deneyimler bu sıcaklığın -273,15 °C olduğunu ve gazın özelliklerine bağlı olmadığını göstermektedir. Deneysel olarak, soğutma yoluyla sıfır basınçta bir gaz elde etmek imkansızdır çünkü çok düşük sıcaklıklarda tüm gazlar sıvı veya katı duruma dönüşür.
 Moleküler-kinetik teori İngiliz fizikçi W. Kelvin (Thomson) 1848'de yeni bir sıcaklık ölçeği (Kelvin ölçeği) oluşturmak için sıfır gaz basıncı noktasının kullanılmasını önerdi. Bu ölçekte sıcaklık ölçüm birimi Celsius ölçeğindekiyle aynıdır, ancak sıfır noktası kaydırılmıştır: TK = TC + 273.15 SI sisteminde sıcaklık birimini Kelvin ölçeğinde Kelvin olarak adlandırmak gelenekseldir. K harfiyle gösterilir. Örneğin, oda sıcaklığı Kelvin ölçeğinde TC = 20 °C, TC = 293,15 K'ye eşittir.
Moleküler-kinetik teori İngiliz fizikçi W. Kelvin (Thomson) 1848'de yeni bir sıcaklık ölçeği (Kelvin ölçeği) oluşturmak için sıfır gaz basıncı noktasının kullanılmasını önerdi. Bu ölçekte sıcaklık ölçüm birimi Celsius ölçeğindekiyle aynıdır, ancak sıfır noktası kaydırılmıştır: TK = TC + 273.15 SI sisteminde sıcaklık birimini Kelvin ölçeğinde Kelvin olarak adlandırmak gelenekseldir. K harfiyle gösterilir. Örneğin, oda sıcaklığı Kelvin ölçeğinde TC = 20 °C, TC = 293,15 K'ye eşittir.
 Moleküler kinetik teori Kelvin sıcaklık ölçeğine mutlak sıcaklık ölçeği denir. Fiziksel teorileri oluşturmak için en uygun sıcaklık ölçeği olduğu ortaya çıktı. Kelvin ölçeğini iki sabit noktaya bağlamaya gerek yoktur; Celsius ölçeğinde alışılmış olduğu gibi buzun erime noktası ve normal atmosfer basıncında suyun kaynama noktası. Mutlak sıfır sıcaklığı olarak adlandırılan sıfır gaz basıncı noktasına ek olarak başka bir sabit referans noktasının da mutlak sıfır sıcaklığı olarak alınması yeterlidir. Kelvin ölçeğinde suyun üçlü noktasının sıcaklığı (0,01 °C), üç fazın (buz, su ve buhar) termal dengede olduğu bir nokta olarak kullanılır. Kelvin ölçeğinde üçlü noktanın sıcaklığı 273,16 K olarak alınır.
Moleküler kinetik teori Kelvin sıcaklık ölçeğine mutlak sıcaklık ölçeği denir. Fiziksel teorileri oluşturmak için en uygun sıcaklık ölçeği olduğu ortaya çıktı. Kelvin ölçeğini iki sabit noktaya bağlamaya gerek yoktur; Celsius ölçeğinde alışılmış olduğu gibi buzun erime noktası ve normal atmosfer basıncında suyun kaynama noktası. Mutlak sıfır sıcaklığı olarak adlandırılan sıfır gaz basıncı noktasına ek olarak başka bir sabit referans noktasının da mutlak sıfır sıcaklığı olarak alınması yeterlidir. Kelvin ölçeğinde suyun üçlü noktasının sıcaklığı (0,01 °C), üç fazın (buz, su ve buhar) termal dengede olduğu bir nokta olarak kullanılır. Kelvin ölçeğinde üçlü noktanın sıcaklığı 273,16 K olarak alınır.
 Moleküler-kinetik teori Böylece, sabit hacimli bir kaptaki (V) seyreltilmiş bir gazın basıncı, mutlak sıcaklığıyla doğru orantılı olarak değişir: p ~ T. T Öte yandan, deneyimler, sabit hacim V ve sıcaklık T ile, gaz basıncı, belirli bir kaptaki ν maddesi miktarının kabın hacmi V'ye oranıyla doğru orantılı olarak değişir; burada N, kaptaki molekül sayısıdır, NA, Avogadro sabitidir, n = N / V konsantrasyondur molekül sayısı (yani kabın birim hacmi başına molekül sayısı).
Moleküler-kinetik teori Böylece, sabit hacimli bir kaptaki (V) seyreltilmiş bir gazın basıncı, mutlak sıcaklığıyla doğru orantılı olarak değişir: p ~ T. T Öte yandan, deneyimler, sabit hacim V ve sıcaklık T ile, gaz basıncı, belirli bir kaptaki ν maddesi miktarının kabın hacmi V'ye oranıyla doğru orantılı olarak değişir; burada N, kaptaki molekül sayısıdır, NA, Avogadro sabitidir, n = N / V konsantrasyondur molekül sayısı (yani kabın birim hacmi başına molekül sayısı).
 Moleküler kinetik teori Bu orantılılık ilişkilerini birleştirerek şunu yazabiliriz: p = nk. T, burada k tüm gazlar için evrensel bir sabit değerdir. MKT'nin yaratıcılarından biri olan Avusturyalı fizikçi L. Boltzmann'ın onuruna Boltzmann sabiti denir. Boltzmann sabiti temel fiziksel sabitlerden biridir. SI cinsinden sayısal değeri: k = 1,38·10–23 J/K.
Moleküler kinetik teori Bu orantılılık ilişkilerini birleştirerek şunu yazabiliriz: p = nk. T, burada k tüm gazlar için evrensel bir sabit değerdir. MKT'nin yaratıcılarından biri olan Avusturyalı fizikçi L. Boltzmann'ın onuruna Boltzmann sabiti denir. Boltzmann sabiti temel fiziksel sabitlerden biridir. SI cinsinden sayısal değeri: k = 1,38·10–23 J/K.
 Moleküler kinetik teorisi p = nk oranlarının karşılaştırılması. Gazların MKT'sinin temel denklemi ile T şu şekilde elde edilebilir: Gaz moleküllerinin kaotik hareketinin ortalama kinetik enerjisi, mutlak sıcaklıkla doğru orantılıdır. Dolayısıyla sıcaklık, moleküllerin öteleme hareketinin ortalama kinetik enerjisinin bir ölçüsüdür. Bir molekülün öteleme hareketinin ortalama kinetik enerjisinin kütlesine bağlı olmadığına dikkat edilmelidir. Bir sıvı veya gaz içinde asılı duran bir Brownian parçacığı, bireysel bir molekülle aynı ortalama kinetik enerjiye sahiptir; kütlesi, Brownian parçacığının kütlesinden birçok büyüklük sırası daha azdır.
Moleküler kinetik teorisi p = nk oranlarının karşılaştırılması. Gazların MKT'sinin temel denklemi ile T şu şekilde elde edilebilir: Gaz moleküllerinin kaotik hareketinin ortalama kinetik enerjisi, mutlak sıcaklıkla doğru orantılıdır. Dolayısıyla sıcaklık, moleküllerin öteleme hareketinin ortalama kinetik enerjisinin bir ölçüsüdür. Bir molekülün öteleme hareketinin ortalama kinetik enerjisinin kütlesine bağlı olmadığına dikkat edilmelidir. Bir sıvı veya gaz içinde asılı duran bir Brownian parçacığı, bireysel bir molekülle aynı ortalama kinetik enerjiye sahiptir; kütlesi, Brownian parçacığının kütlesinden birçok büyüklük sırası daha azdır.
 Moleküler-kinetik teori Bu sonuç aynı zamanda kabın, molekülleri farklı kütlelere sahip, kimyasal olarak etkileşime girmeyen gazların bir karışımını içerdiği durum için de geçerlidir. Denge durumunda, farklı gazların molekülleri, yalnızca karışımın sıcaklığıyla belirlenen aynı ortalama termal hareket kinetik enerjisine sahip olacaktır. Gaz karışımının kabın duvarları üzerindeki basıncı, her bir gazın kısmi basınçlarının toplamı olacaktır: p = p 1 + p 2 + p 3 + ... = (n 1 + n 2 + n 3 + . ..)k. T Bu oranda n 1, n 2, n 3, ... karışımdaki çeşitli gazların moleküllerinin konsantrasyonlarıdır. Bu ilişki deneysel olarak kurulan moleküler kinetik teorinin dilinde ifade edilmiştir. XIX'in başı yüzyıl Dalton yasası: Dalton yasasının kimyasal olarak etkileşime girmeyen gazlardan oluşan bir karışımındaki basınç, kısmi basınçlarının toplamına eşittir.
Moleküler-kinetik teori Bu sonuç aynı zamanda kabın, molekülleri farklı kütlelere sahip, kimyasal olarak etkileşime girmeyen gazların bir karışımını içerdiği durum için de geçerlidir. Denge durumunda, farklı gazların molekülleri, yalnızca karışımın sıcaklığıyla belirlenen aynı ortalama termal hareket kinetik enerjisine sahip olacaktır. Gaz karışımının kabın duvarları üzerindeki basıncı, her bir gazın kısmi basınçlarının toplamı olacaktır: p = p 1 + p 2 + p 3 + ... = (n 1 + n 2 + n 3 + . ..)k. T Bu oranda n 1, n 2, n 3, ... karışımdaki çeşitli gazların moleküllerinin konsantrasyonlarıdır. Bu ilişki deneysel olarak kurulan moleküler kinetik teorinin dilinde ifade edilmiştir. XIX'in başı yüzyıl Dalton yasası: Dalton yasasının kimyasal olarak etkileşime girmeyen gazlardan oluşan bir karışımındaki basınç, kısmi basınçlarının toplamına eşittir.
 Moleküler kinetik teori İdeal bir gazın durum denklemi İlişki p = nk. T, bir gazın makroskopik parametreleri - hacim V, basınç p, sıcaklık T ve madde miktarı ν = m / M arasında bir ilişki kuran başka bir biçimde yazılabilir. M –– Bu ilişkiye durum denklemi denir. ideal bir gaz veya ideal bir gazın Clapeyron-Mendeleev durum denklemi - Avogadro sabiti NA ile Boltzmann sabiti k'nin çarpımına evrensel gaz sabiti denir ve R harfiyle gösterilir. SI'daki sayısal değeri: R = k ∙NA = 8,31 J/mol K.
Moleküler kinetik teori İdeal bir gazın durum denklemi İlişki p = nk. T, bir gazın makroskopik parametreleri - hacim V, basınç p, sıcaklık T ve madde miktarı ν = m / M arasında bir ilişki kuran başka bir biçimde yazılabilir. M –– Bu ilişkiye durum denklemi denir. ideal bir gaz veya ideal bir gazın Clapeyron-Mendeleev durum denklemi - Avogadro sabiti NA ile Boltzmann sabiti k'nin çarpımına evrensel gaz sabiti denir ve R harfiyle gösterilir. SI'daki sayısal değeri: R = k ∙NA = 8,31 J/mol K.
 Moleküler kinetik teori İdeal bir gazın durum denklemi - Gaz sıcaklığı Tn = 273,15 K (0 °C) ve basınç pn = 1 atm = 1,013·105 Pa ise, gazın normal koşullar altında olduğu söylenir. İdeal bir gazın durum denkleminden takip edildiği gibi, normal koşullar altında herhangi bir gazın bir molü aynı hacmi kaplar. V0 = 0,0224 m3/mol = 22,4 dm3/mol. Bu ifadeye Avogadro yasası denir.
Moleküler kinetik teori İdeal bir gazın durum denklemi - Gaz sıcaklığı Tn = 273,15 K (0 °C) ve basınç pn = 1 atm = 1,013·105 Pa ise, gazın normal koşullar altında olduğu söylenir. İdeal bir gazın durum denkleminden takip edildiği gibi, normal koşullar altında herhangi bir gazın bir molü aynı hacmi kaplar. V0 = 0,0224 m3/mol = 22,4 dm3/mol. Bu ifadeye Avogadro yasası denir.
 Moleküler kinetik teori İzoprosesler Bir gaz, durumunu tanımlayan tüm parametrelerin (p, V ve T) değişebileceği çeşitli termal işlemlere katılabilir. Süreç yeterince yavaş ilerlerse sistem her an denge durumuna yaklaşır. Bu tür işlemlere yarı statik denir. Bizim için tanıdık yarı statik zaman ölçeğinde bu süreçler çok yavaş ilerlemeyebilir. Örneğin, saniyede yüzlerce kez meydana gelen bir ses dalgasındaki gazın seyrelmesi ve sıkıştırılması, yarı statik bir süreç olarak düşünülebilir. Yarı statik süreçler, her noktası bir denge durumunu temsil eden bir yörünge biçiminde bir durum diyagramında (örneğin, p, V koordinatlarında) gösterilebilir. Parametrelerden birinin (p, V veya T) değişmeden kaldığı süreçler ilgi çekicidir. Bu tür işlemlere izoprosesler denir
Moleküler kinetik teori İzoprosesler Bir gaz, durumunu tanımlayan tüm parametrelerin (p, V ve T) değişebileceği çeşitli termal işlemlere katılabilir. Süreç yeterince yavaş ilerlerse sistem her an denge durumuna yaklaşır. Bu tür işlemlere yarı statik denir. Bizim için tanıdık yarı statik zaman ölçeğinde bu süreçler çok yavaş ilerlemeyebilir. Örneğin, saniyede yüzlerce kez meydana gelen bir ses dalgasındaki gazın seyrelmesi ve sıkıştırılması, yarı statik bir süreç olarak düşünülebilir. Yarı statik süreçler, her noktası bir denge durumunu temsil eden bir yörünge biçiminde bir durum diyagramında (örneğin, p, V koordinatlarında) gösterilebilir. Parametrelerden birinin (p, V veya T) değişmeden kaldığı süreçler ilgi çekicidir. Bu tür işlemlere izoprosesler denir
 İzotermal süreç (T = sabit) Bir izotermal süreç, sabit bir T sıcaklığında meydana gelen yarı statik bir süreçtir. İdeal bir gazın durum denkleminden, sabit bir T ve T sıcaklığında, gazın içinde sabit miktarda ν maddesi olduğu sonucu çıkar. kapta, gazın basıncı p ile p hacmi V'nin çarpımı sabit kalmalıdır: p. V = sabit
İzotermal süreç (T = sabit) Bir izotermal süreç, sabit bir T sıcaklığında meydana gelen yarı statik bir süreçtir. İdeal bir gazın durum denkleminden, sabit bir T ve T sıcaklığında, gazın içinde sabit miktarda ν maddesi olduğu sonucu çıkar. kapta, gazın basıncı p ile p hacmi V'nin çarpımı sabit kalmalıdır: p. V = sabit
 İzotermal süreç (T = sabit) (p, V) düzleminde, farklı T sıcaklıklarında izotermal süreçler, izotermler olarak adlandırılan bir p ~ 1 / V hiperbol ailesi tarafından tasvir edilir. İzotermal sürecin denklemi İngiliz fizikçi R. Boyle (1662) ve bağımsız olarak Fransız fizikçi E. Mariotte (1676) tarafından yapılan deneyden elde edilmiştir. Bu nedenle denklem Boyle-Mariotte yasası olarak adlandırılır. T 3 > T 2 > T 1
İzotermal süreç (T = sabit) (p, V) düzleminde, farklı T sıcaklıklarında izotermal süreçler, izotermler olarak adlandırılan bir p ~ 1 / V hiperbol ailesi tarafından tasvir edilir. İzotermal sürecin denklemi İngiliz fizikçi R. Boyle (1662) ve bağımsız olarak Fransız fizikçi E. Mariotte (1676) tarafından yapılan deneyden elde edilmiştir. Bu nedenle denklem Boyle-Mariotte yasası olarak adlandırılır. T 3 > T 2 > T 1
 İzokorik süreç (V = sabit) İzokorik süreç, kaptaki ν maddesi miktarının değişmeden kalması koşuluyla, sabit bir V hacminde bir gazın yarı statik ısıtılması veya soğutulması işlemidir. İdeal bir gazın durum denkleminden aşağıdaki gibi, bu koşullar altında gaz basıncı p, mutlak sıcaklığıyla doğru orantılı olarak değişir: p ~ T veya = sabit
İzokorik süreç (V = sabit) İzokorik süreç, kaptaki ν maddesi miktarının değişmeden kalması koşuluyla, sabit bir V hacminde bir gazın yarı statik ısıtılması veya soğutulması işlemidir. İdeal bir gazın durum denkleminden aşağıdaki gibi, bu koşullar altında gaz basıncı p, mutlak sıcaklığıyla doğru orantılı olarak değişir: p ~ T veya = sabit
 İzokorik süreç (V = sabit) Düzlemde (p, T), farklı hacim değerlerinde V'de belirli bir madde ν miktarı için izokorik süreçler, izokor adı verilen bir düz çizgi ailesi tarafından gösterilir. Daha büyük hacim değerleri, sıcaklık eksenine göre daha küçük eğime sahip izokorlara karşılık gelir (Şekil). Gaz basıncının sıcaklığa bağımlılığı Fransız fizikçi J. Charles (1787) tarafından deneysel olarak incelenmiştir. Bu nedenle izokorik bir sürecin denklemine Charles yasası denir. V 3 > V 2 > V 1
İzokorik süreç (V = sabit) Düzlemde (p, T), farklı hacim değerlerinde V'de belirli bir madde ν miktarı için izokorik süreçler, izokor adı verilen bir düz çizgi ailesi tarafından gösterilir. Daha büyük hacim değerleri, sıcaklık eksenine göre daha küçük eğime sahip izokorlara karşılık gelir (Şekil). Gaz basıncının sıcaklığa bağımlılığı Fransız fizikçi J. Charles (1787) tarafından deneysel olarak incelenmiştir. Bu nedenle izokorik bir sürecin denklemine Charles yasası denir. V 3 > V 2 > V 1
 İzobarik süreç (p = sabit) İzobarik süreç, sabit p basıncında meydana gelen yarı statik bir süreçtir. Belirli bir sabit miktardaki ν maddesi için izobarik bir sürecin denklemi şu şekildedir: burada V 0, 0 °C sıcaklıktaki gazın hacmidir. α katsayısı (1/273, 15) K– 1'e eşittir. α'sına gazların hacimsel genleşmesinin sıcaklık katsayısı denir.
İzobarik süreç (p = sabit) İzobarik süreç, sabit p basıncında meydana gelen yarı statik bir süreçtir. Belirli bir sabit miktardaki ν maddesi için izobarik bir sürecin denklemi şu şekildedir: burada V 0, 0 °C sıcaklıktaki gazın hacmidir. α katsayısı (1/273, 15) K– 1'e eşittir. α'sına gazların hacimsel genleşmesinin sıcaklık katsayısı denir.
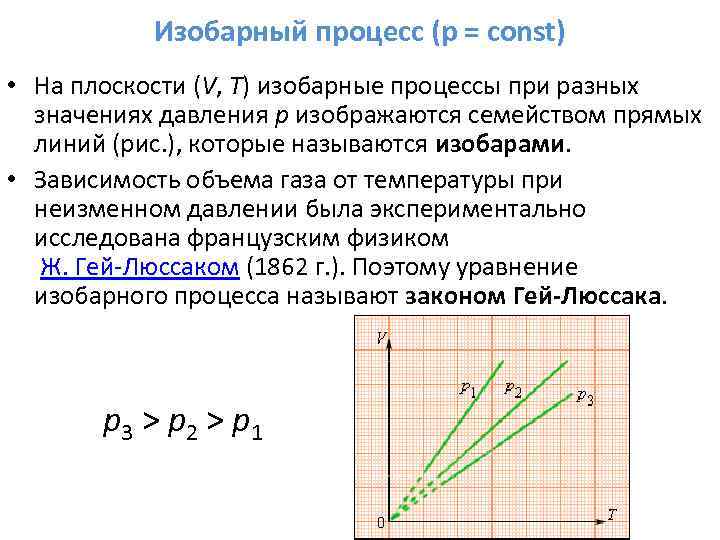 İzobarik süreç (p = sabit) Düzlemde (V, T), farklı basınç p değerlerindeki izobarik süreçler, izobar adı verilen bir düz çizgi ailesi (Şekil) ile gösterilir. Sabit basınçta gaz hacminin sıcaklığa bağımlılığı, Fransız fizikçi J. Gay-Lussac (1862) tarafından deneysel olarak incelenmiştir. Bu nedenle izobarik sürecin denklemine Gay-Lussac yasası denir. p 3 > p 2 > p 1
İzobarik süreç (p = sabit) Düzlemde (V, T), farklı basınç p değerlerindeki izobarik süreçler, izobar adı verilen bir düz çizgi ailesi (Şekil) ile gösterilir. Sabit basınçta gaz hacminin sıcaklığa bağımlılığı, Fransız fizikçi J. Gay-Lussac (1862) tarafından deneysel olarak incelenmiştir. Bu nedenle izobarik sürecin denklemine Gay-Lussac yasası denir. p 3 > p 2 > p 1
 İzoprosesler Boyle-Mariotte, Charles ve Gay-Lussac'ın deneysel olarak oluşturulmuş yasaları, gazların moleküler kinetik teorisinde bir açıklama bulur. Bunlar ideal gaz durum denkleminin bir sonucudur.
İzoprosesler Boyle-Mariotte, Charles ve Gay-Lussac'ın deneysel olarak oluşturulmuş yasaları, gazların moleküler kinetik teorisinde bir açıklama bulur. Bunlar ideal gaz durum denkleminin bir sonucudur.
 Termodinamik Termodinamik, termal olayların bilimidir. Fikirlere dayanarak sonuçlar çıkaran moleküler kinetik teorinin aksine moleküler yapı maddeler, termodinamik en çok gelir genel desenlerısıl işlemler ve makroskobik sistemlerin özellikleri. Termodinamiğin sonuçları bir dizi deneysel gerçeğe dayanmaktadır ve maddenin iç yapısına ilişkin bilgimize bağlı değildir; ancak bazı durumlarda termodinamik, sonuçlarını açıklamak için moleküler kinetik modelleri kullanır.
Termodinamik Termodinamik, termal olayların bilimidir. Fikirlere dayanarak sonuçlar çıkaran moleküler kinetik teorinin aksine moleküler yapı maddeler, termodinamik en çok gelir genel desenlerısıl işlemler ve makroskobik sistemlerin özellikleri. Termodinamiğin sonuçları bir dizi deneysel gerçeğe dayanmaktadır ve maddenin iç yapısına ilişkin bilgimize bağlı değildir; ancak bazı durumlarda termodinamik, sonuçlarını açıklamak için moleküler kinetik modelleri kullanır.
 Termodinamik Termodinamik, termodinamik denge durumundaki izole edilmiş cisim sistemlerini dikkate alır. Bu, bu tür sistemlerde gözlemlenebilir tüm makroskobik süreçlerin durduğu anlamına gelir.
Termodinamik Termodinamik, termodinamik denge durumundaki izole edilmiş cisim sistemlerini dikkate alır. Bu, bu tür sistemlerde gözlemlenebilir tüm makroskobik süreçlerin durduğu anlamına gelir.
 Termodinamik Eğer bir termodinamik sistem dış etkilere maruz kalırsa, eninde sonunda başka bir denge durumuna geçecektir. Bu geçişe termodinamik süreç denir. Süreç yeterince yavaş ilerlerse (sonsuz derecede yavaş), o zaman sistem zamanın her anında denge durumuna yakın olur. Bir dizi denge durumundan oluşan süreçlere yarı statik denir.
Termodinamik Eğer bir termodinamik sistem dış etkilere maruz kalırsa, eninde sonunda başka bir denge durumuna geçecektir. Bu geçişe termodinamik süreç denir. Süreç yeterince yavaş ilerlerse (sonsuz derecede yavaş), o zaman sistem zamanın her anında denge durumuna yakın olur. Bir dizi denge durumundan oluşan süreçlere yarı statik denir.
 Termodinamik. İç enerji Termodinamiğin en önemli kavramlarından biri cismin iç enerjisidir. Tüm makroskobik cisimler, cisimlerin kendilerinde bulunan enerjiye sahiptir. MCT açısından bakıldığında, bir maddenin iç enerjisi, tüm atomların ve moleküllerin kinetik enerjisinden ve bunların birbirleriyle etkileşimlerinin potansiyel enerjisinden oluşur. Özellikle ideal bir gazın iç enerjisi, sürekli ve rastgele termal hareket halindeki tüm gaz parçacıklarının kinetik enerjilerinin toplamına eşittir. Bu, çok sayıda deneyle doğrulanan Joule yasasını ima eder: İdeal bir gazın iç enerjisi yalnızca sıcaklığına bağlıdır, hacmine bağlı değildir.
Termodinamik. İç enerji Termodinamiğin en önemli kavramlarından biri cismin iç enerjisidir. Tüm makroskobik cisimler, cisimlerin kendilerinde bulunan enerjiye sahiptir. MCT açısından bakıldığında, bir maddenin iç enerjisi, tüm atomların ve moleküllerin kinetik enerjisinden ve bunların birbirleriyle etkileşimlerinin potansiyel enerjisinden oluşur. Özellikle ideal bir gazın iç enerjisi, sürekli ve rastgele termal hareket halindeki tüm gaz parçacıklarının kinetik enerjilerinin toplamına eşittir. Bu, çok sayıda deneyle doğrulanan Joule yasasını ima eder: İdeal bir gazın iç enerjisi yalnızca sıcaklığına bağlıdır, hacmine bağlı değildir.
 Termodinamik. MKT'nin iç enerjisi, molekülleri yalnızca öteleme hareketi gerçekleştiren ideal tek atomlu bir gazın (helyum, neon vb.) bir molünün iç enerjisi için aşağıdaki ifadeye yol açar: Çünkü potansiyel enerji moleküllerin etkileşimi aralarındaki mesafeye bağlıdır; genel durumda, bir cismin iç enerjisi U, sıcaklık T ile birlikte aynı zamanda V hacmine de bağlıdır: T U = U (T, V) Dolayısıyla, iç enerji Bir cismin U'su, cismin durumunu karakterize eden makroskopik parametrelerle benzersiz bir şekilde belirlenir. Nasıl uygulandığına bağlı değil bu durum. Genellikle iç enerjinin durumun bir fonksiyonu olduğu söylenir.
Termodinamik. MKT'nin iç enerjisi, molekülleri yalnızca öteleme hareketi gerçekleştiren ideal tek atomlu bir gazın (helyum, neon vb.) bir molünün iç enerjisi için aşağıdaki ifadeye yol açar: Çünkü potansiyel enerji moleküllerin etkileşimi aralarındaki mesafeye bağlıdır; genel durumda, bir cismin iç enerjisi U, sıcaklık T ile birlikte aynı zamanda V hacmine de bağlıdır: T U = U (T, V) Dolayısıyla, iç enerji Bir cismin U'su, cismin durumunu karakterize eden makroskopik parametrelerle benzersiz bir şekilde belirlenir. Nasıl uygulandığına bağlı değil bu durum. Genellikle iç enerjinin durumun bir fonksiyonu olduğu söylenir.
 Termodinamik. İç enerjiyi değiştirmenin yolları Bir cismin iç enerjisi, eğer ona etki eden dış kuvvetler iş yaparsa (pozitif veya negatif) değişebilir. iş Örneğin, bir gaz pistonun altındaki bir silindirde sıkıştırılırsa, dış kuvvetler gaz üzerinde bir miktar pozitif A işi yapar. Aynı zamanda, gazdan pistona etki eden basınç kuvvetleri A = – işi yapar. A"
Termodinamik. İç enerjiyi değiştirmenin yolları Bir cismin iç enerjisi, eğer ona etki eden dış kuvvetler iş yaparsa (pozitif veya negatif) değişebilir. iş Örneğin, bir gaz pistonun altındaki bir silindirde sıkıştırılırsa, dış kuvvetler gaz üzerinde bir miktar pozitif A işi yapar. Aynı zamanda, gazdan pistona etki eden basınç kuvvetleri A = – işi yapar. A"
 Termodinamik. İç enerjiyi değiştirme yöntemleri Bir vücudun iç enerjisi yalnızca yapılan işin bir sonucu olarak değil, aynı zamanda ısı değişiminin bir sonucu olarak da değişebilir. Cisimler termal temasa girdiğinde birinin iç enerjisi artabilir, diğerinin ise azalabilir. Bu durumda bir vücuttan diğerine ısı akışından bahsediyoruz. Vücudun aldığı ısı miktarı Q Isı miktarı Q, ısı değişimi sonucunda vücudun iç enerjisindeki değişimdir.
Termodinamik. İç enerjiyi değiştirme yöntemleri Bir vücudun iç enerjisi yalnızca yapılan işin bir sonucu olarak değil, aynı zamanda ısı değişiminin bir sonucu olarak da değişebilir. Cisimler termal temasa girdiğinde birinin iç enerjisi artabilir, diğerinin ise azalabilir. Bu durumda bir vücuttan diğerine ısı akışından bahsediyoruz. Vücudun aldığı ısı miktarı Q Isı miktarı Q, ısı değişimi sonucunda vücudun iç enerjisindeki değişimdir.
 Termodinamik. İç enerjiyi değiştirme yöntemleri Enerjinin bir vücuttan diğerine ısı şeklinde aktarılması ancak aralarında sıcaklık farkı olması durumunda gerçekleşebilir. Isı akışı her zaman sıcak bir cisimden soğuk olana doğru yönlendirilir. Isı miktarı Q bir enerji miktarıdır. SI'da, ısı miktarı mekanik iş birimi - joule (J) cinsinden ölçülür.
Termodinamik. İç enerjiyi değiştirme yöntemleri Enerjinin bir vücuttan diğerine ısı şeklinde aktarılması ancak aralarında sıcaklık farkı olması durumunda gerçekleşebilir. Isı akışı her zaman sıcak bir cisimden soğuk olana doğru yönlendirilir. Isı miktarı Q bir enerji miktarıdır. SI'da, ısı miktarı mekanik iş birimi - joule (J) cinsinden ölçülür.
 Termodinamik. Termodinamiğin birinci yasası Şekil 2'de yer almaktadır. Seçilen termodinamik sistem ile çevredeki cisimler arasındaki enerji akışı geleneksel olarak gösterilmektedir. Termal akış Q > 0 termodinamik sisteme doğru yönlendirilmişse, Q > 0 değeri. Sistem çevredeki cisimler üzerinde pozitif A > 0 iş yapıyorsa A > 0 değeri. Sistem çevredeki cisimlerle ısı alışverişi yapıyorsa ve iş yapıyorsa (pozitif veya negatif), o zaman sistemin durumu değişir, sistemin durumu değişir, yani. makroskopik parametreleri (sıcaklık, basınç, hacim) değişir.
Termodinamik. Termodinamiğin birinci yasası Şekil 2'de yer almaktadır. Seçilen termodinamik sistem ile çevredeki cisimler arasındaki enerji akışı geleneksel olarak gösterilmektedir. Termal akış Q > 0 termodinamik sisteme doğru yönlendirilmişse, Q > 0 değeri. Sistem çevredeki cisimler üzerinde pozitif A > 0 iş yapıyorsa A > 0 değeri. Sistem çevredeki cisimlerle ısı alışverişi yapıyorsa ve iş yapıyorsa (pozitif veya negatif), o zaman sistemin durumu değişir, sistemin durumu değişir, yani. makroskopik parametreleri (sıcaklık, basınç, hacim) değişir.
 Termodinamik. Termodinamiğin birinci yasası İç enerji U, sistemin durumunu karakterize eden makroskopik parametreler tarafından benzersiz bir şekilde belirlendiğinden, ısı alışverişi ve iş süreçlerine, sistemin iç enerjisindeki bir ΔU değişikliğinin eşlik ettiği sonucu çıkar.
Termodinamik. Termodinamiğin birinci yasası İç enerji U, sistemin durumunu karakterize eden makroskopik parametreler tarafından benzersiz bir şekilde belirlendiğinden, ısı alışverişi ve iş süreçlerine, sistemin iç enerjisindeki bir ΔU değişikliğinin eşlik ettiği sonucu çıkar.
 Termodinamik. Termodinamiğin birinci yasası Termodinamiğin birinci yasası, bir termodinamik sistem için enerjinin korunumu ve dönüşümü yasasının genelleştirilmesidir. Aşağıdaki gibi formüle edilir: Yalıtılmamış bir termodinamik sistemin iç enerjisinin ΔU değişimi, sisteme aktarılan ısı miktarı Q ile sistemin dış cisimler üzerinde yaptığı A işi arasındaki farka eşittir. ΔU = Q – A Termodinamiğin birinci yasasını ifade eden ilişki genellikle başka bir biçimde yazılır: Q = ΔU + A Sistemin aldığı ısı miktarı, sistemin iç enerjisini değiştirmeye ve dış cisimler üzerinde iş yapmaya gider.
Termodinamik. Termodinamiğin birinci yasası Termodinamiğin birinci yasası, bir termodinamik sistem için enerjinin korunumu ve dönüşümü yasasının genelleştirilmesidir. Aşağıdaki gibi formüle edilir: Yalıtılmamış bir termodinamik sistemin iç enerjisinin ΔU değişimi, sisteme aktarılan ısı miktarı Q ile sistemin dış cisimler üzerinde yaptığı A işi arasındaki farka eşittir. ΔU = Q – A Termodinamiğin birinci yasasını ifade eden ilişki genellikle başka bir biçimde yazılır: Q = ΔU + A Sistemin aldığı ısı miktarı, sistemin iç enerjisini değiştirmeye ve dış cisimler üzerinde iş yapmaya gider.
 Termodinamik. Termodinamiğin birinci yasası Termodinamiğin birinci yasasını gazlardaki izoproseslere uygulayalım. İzokorik bir süreçte (V = sabit), gaz iş yapmaz, A = 0. Dolayısıyla Q = ΔU = U (T 2) – U (T 1). Burada U (T 1) ve U (T 2), gazın başlangıç ve son durumlarındaki iç enerjileridir. İdeal bir gazın iç enerjisi yalnızca sıcaklığa bağlıdır (Joule yasası). İzokorik ısıtma sırasında ısı gaz tarafından emilir (Q > 0) ve iç enerjisi artar. Soğutma sırasında, ısı dış cisimlere aktarılır (Q 0 - ısı gaz tarafından emilir ve gaz pozitif iş yapar. İzobarik sıkıştırma ile Q)
Termodinamik. Termodinamiğin birinci yasası Termodinamiğin birinci yasasını gazlardaki izoproseslere uygulayalım. İzokorik bir süreçte (V = sabit), gaz iş yapmaz, A = 0. Dolayısıyla Q = ΔU = U (T 2) – U (T 1). Burada U (T 1) ve U (T 2), gazın başlangıç ve son durumlarındaki iç enerjileridir. İdeal bir gazın iç enerjisi yalnızca sıcaklığa bağlıdır (Joule yasası). İzokorik ısıtma sırasında ısı gaz tarafından emilir (Q > 0) ve iç enerjisi artar. Soğutma sırasında, ısı dış cisimlere aktarılır (Q 0 - ısı gaz tarafından emilir ve gaz pozitif iş yapar. İzobarik sıkıştırma ile Q)
 Isı motorları. Termodinamik çevrimler. Carnot çevrimi Isı motoru, alınan ısı miktarını mekanik işe dönüştürebilen bir cihazdır. Isı motorlarında mekanik çalışma, çalışma akışkanı adı verilen bir maddenin genleşmesi sürecinde gerçekleştirilir. Çalışma akışkanı olarak genellikle gaz halindeki maddeler (benzin buharı, hava, su buharı) kullanılır. Çalışma akışkanı, büyük miktarda iç enerji kaynağına sahip gövdelerle ısı alışverişi sürecinde termal enerji alır (veya serbest bırakır). Bu kütlelere termal rezervuarlar denir. Gerçek hayattaki ısı motorları (buhar motorları, içten yanmalı motorlar vb.) döngüsel olarak çalışır. Isı transferi ve ortaya çıkan ısı miktarının işe dönüştürülmesi işlemi periyodik olarak tekrarlanır. Bunu yapmak için, çalışma akışkanının orijinal durumunun periyodik olarak geri yüklendiği dairesel bir işlemden veya termodinamik döngüden geçmesi gerekir.
Isı motorları. Termodinamik çevrimler. Carnot çevrimi Isı motoru, alınan ısı miktarını mekanik işe dönüştürebilen bir cihazdır. Isı motorlarında mekanik çalışma, çalışma akışkanı adı verilen bir maddenin genleşmesi sürecinde gerçekleştirilir. Çalışma akışkanı olarak genellikle gaz halindeki maddeler (benzin buharı, hava, su buharı) kullanılır. Çalışma akışkanı, büyük miktarda iç enerji kaynağına sahip gövdelerle ısı alışverişi sürecinde termal enerji alır (veya serbest bırakır). Bu kütlelere termal rezervuarlar denir. Gerçek hayattaki ısı motorları (buhar motorları, içten yanmalı motorlar vb.) döngüsel olarak çalışır. Isı transferi ve ortaya çıkan ısı miktarının işe dönüştürülmesi işlemi periyodik olarak tekrarlanır. Bunu yapmak için, çalışma akışkanının orijinal durumunun periyodik olarak geri yüklendiği dairesel bir işlemden veya termodinamik döngüden geçmesi gerekir.
 Isı motorları. Termodinamik çevrimler. Carnot çevrimi Tüm dairesel süreçlerin ortak özelliği, çalışma akışkanının yalnızca bir termal rezervuarla termal temasa getirilmesiyle gerçekleştirilememeleridir. Bunlardan en az ikisine ihtiyacınız var. Sıcaklığı daha yüksek olan ısı deposuna ısıtıcı, sıcaklığı daha düşük olan ısı deposuna ise buzdolabı denir. Dairesel bir işlem gerçekleştiren çalışma akışkanı, ısıtıcıdan belirli bir miktarda Q 1 > 0 ısı alır ve bir miktar Q 2 ısısını buzdolabına aktarır.
Isı motorları. Termodinamik çevrimler. Carnot çevrimi Tüm dairesel süreçlerin ortak özelliği, çalışma akışkanının yalnızca bir termal rezervuarla termal temasa getirilmesiyle gerçekleştirilememeleridir. Bunlardan en az ikisine ihtiyacınız var. Sıcaklığı daha yüksek olan ısı deposuna ısıtıcı, sıcaklığı daha düşük olan ısı deposuna ise buzdolabı denir. Dairesel bir işlem gerçekleştiren çalışma akışkanı, ısıtıcıdan belirli bir miktarda Q 1 > 0 ısı alır ve bir miktar Q 2 ısısını buzdolabına aktarır.
 Isı motorları. Termodinamik çevrimler. Carnot döngüsü Çalışma akışkanının çevrim başına gerçekleştirdiği İş A, çevrim başına alınan Q ısı miktarına eşittir. A işinin, çalışma akışkanının ısıtıcıdan çevrim başına aldığı Q1 ısı miktarına oranına verimlilik η denir. ısı makinesinin:
Isı motorları. Termodinamik çevrimler. Carnot döngüsü Çalışma akışkanının çevrim başına gerçekleştirdiği İş A, çevrim başına alınan Q ısı miktarına eşittir. A işinin, çalışma akışkanının ısıtıcıdan çevrim başına aldığı Q1 ısı miktarına oranına verimlilik η denir. ısı makinesinin:
 Isı motorları. Termodinamik çevrimler. Carnot çevrimi Verimlilik katsayısı, çalışma akışkanının “sıcak” termal rezervuardan aldığı termal enerjinin ne kadarının faydalı işe dönüştürüldüğünü gösterir. Geri kalan kısım (1 – η) “işe yaramaz” bir şekilde buzdolabına aktarıldı. (1 – η) Bir ısı makinesinin verimi her zaman birden küçüktür (η 0, A > 0, Q 2 T 2
Isı motorları. Termodinamik çevrimler. Carnot çevrimi Verimlilik katsayısı, çalışma akışkanının “sıcak” termal rezervuardan aldığı termal enerjinin ne kadarının faydalı işe dönüştürüldüğünü gösterir. Geri kalan kısım (1 – η) “işe yaramaz” bir şekilde buzdolabına aktarıldı. (1 – η) Bir ısı makinesinin verimi her zaman birden küçüktür (η 0, A > 0, Q 2 T 2
 Isı motorları. Termodinamik çevrimler. Carnot döngüsü 1824'te Fransız mühendis S. Carnot, iki izoterm ve iki adiabattan oluşan dairesel bir süreç düşündü. önemli rol termal süreçler doktrininin geliştirilmesinde. Buna Carnot döngüsü denir (Şekil 3.11.4).
Isı motorları. Termodinamik çevrimler. Carnot döngüsü 1824'te Fransız mühendis S. Carnot, iki izoterm ve iki adiabattan oluşan dairesel bir süreç düşündü. önemli rol termal süreçler doktrininin geliştirilmesinde. Buna Carnot döngüsü denir (Şekil 3.11.4).
 Isı motorları. Termodinamik çevrimler. Carnot çevrimi Carnot çevrimi, pistonun altındaki silindirde bulunan bir gaz tarafından gerçekleştirilir. İzotermal bölümde (1-2), gaz, T 1 sıcaklığına sahip sıcak bir termal rezervuar (ısıtıcı) ile termal temasa getirilir. Gaz, izotermal olarak genleşerek A 12 işi yaparken, belirli miktarda ısı Q 1 = Gaza A 12 verilir. Daha sonra adyabatik bölümde (2-3), gaz adyabatik bir kabuğa yerleştirilir ve ısı değişimi olmadığında genleşmeye devam eder. Bu bölümde gaz A 23 > 0 işini yapar. Adyabatik genleşme sırasında gazın sıcaklığı T 2 değerine düşer. Bir sonraki izotermal bölümde (3-4), gaz soğuk bir termal madde ile termal temasa getirilir. T 2 sıcaklığında rezervuar (buzdolabı)
Isı motorları. Termodinamik çevrimler. Carnot çevrimi Carnot çevrimi, pistonun altındaki silindirde bulunan bir gaz tarafından gerçekleştirilir. İzotermal bölümde (1-2), gaz, T 1 sıcaklığına sahip sıcak bir termal rezervuar (ısıtıcı) ile termal temasa getirilir. Gaz, izotermal olarak genleşerek A 12 işi yaparken, belirli miktarda ısı Q 1 = Gaza A 12 verilir. Daha sonra adyabatik bölümde (2-3), gaz adyabatik bir kabuğa yerleştirilir ve ısı değişimi olmadığında genleşmeye devam eder. Bu bölümde gaz A 23 > 0 işini yapar. Adyabatik genleşme sırasında gazın sıcaklığı T 2 değerine düşer. Bir sonraki izotermal bölümde (3-4), gaz soğuk bir termal madde ile termal temasa getirilir. T 2 sıcaklığında rezervuar (buzdolabı)
 Termal süreçlerin geri döndürülemezliği. Termodinamiğin ikinci yasası. Termodinamiğin birinci yasası - termal süreçler için enerjinin korunumu yasası - sistem tarafından alınan ısı miktarı Q, iç enerjisindeki ΔU değişimi ve A'nın dış cisimler üzerinde yaptığı iş arasındaki ilişkiyi kurar: Q = ΔU + A Bu yasaya göre enerji yaratılamaz veya yok edilemez; bir sistemden diğerine aktarılır ve bir formdan diğerine dönüştürülür. Termodinamiğin birinci yasasını ihlal eden süreçler hiçbir zaman gözlemlenmemiştir. Şek. termodinamiğin birinci kanunu tarafından yasaklanan cihazları tasvir eder. Termodinamiğin birinci kanunu tarafından yasaklanan çevrimsel olarak çalışan ısı motorları: 1 – 1. tür sürekli hareket makinesi, harici enerji tüketmeden iş yapar; 2 – verimliliği η > 1 olan ısı motoru
Termal süreçlerin geri döndürülemezliği. Termodinamiğin ikinci yasası. Termodinamiğin birinci yasası - termal süreçler için enerjinin korunumu yasası - sistem tarafından alınan ısı miktarı Q, iç enerjisindeki ΔU değişimi ve A'nın dış cisimler üzerinde yaptığı iş arasındaki ilişkiyi kurar: Q = ΔU + A Bu yasaya göre enerji yaratılamaz veya yok edilemez; bir sistemden diğerine aktarılır ve bir formdan diğerine dönüştürülür. Termodinamiğin birinci yasasını ihlal eden süreçler hiçbir zaman gözlemlenmemiştir. Şek. termodinamiğin birinci kanunu tarafından yasaklanan cihazları tasvir eder. Termodinamiğin birinci kanunu tarafından yasaklanan çevrimsel olarak çalışan ısı motorları: 1 – 1. tür sürekli hareket makinesi, harici enerji tüketmeden iş yapar; 2 – verimliliği η > 1 olan ısı motoru
 Termal süreçlerin geri döndürülemezliği. Termodinamiğin ikinci yasası. Termodinamiğin birinci yasası termal süreçlerin yönünü belirlemez. Ancak deneyimlerin gösterdiği gibi birçok termal süreç yalnızca tek yönde gerçekleşebilir. Bu tür işlemlere geri döndürülemez denir. Örneğin, farklı sıcaklıklara sahip iki cismin termal teması sırasında, ısı akışı her zaman daha sıcak olan cisimden daha soğuk olana doğru yönlendirilir. Sıcaklığı düşük bir cisimden sıcaklığı daha yüksek olan bir cisme kendiliğinden ısı transferi asla gerçekleşmez. Sonuç olarak, sonlu bir sıcaklık farkındaki ısı transfer süreci geri döndürülemez. Tersinir süreçler, bir sistemin bir denge durumundan diğerine geçiş süreçleridir ve aynı ara denge durumları dizisi aracılığıyla ters yönde gerçekleştirilebilir. Bu durumda sistemin kendisi ve etrafındaki cisimler orijinal hallerine geri döner. Sistemin her zaman denge durumunda kaldığı süreçlere yarı statik denir. Tüm yarı statik süreçler tersine çevrilebilir. Tersine çevrilebilen tüm süreçler yarı statiktir.
Termal süreçlerin geri döndürülemezliği. Termodinamiğin ikinci yasası. Termodinamiğin birinci yasası termal süreçlerin yönünü belirlemez. Ancak deneyimlerin gösterdiği gibi birçok termal süreç yalnızca tek yönde gerçekleşebilir. Bu tür işlemlere geri döndürülemez denir. Örneğin, farklı sıcaklıklara sahip iki cismin termal teması sırasında, ısı akışı her zaman daha sıcak olan cisimden daha soğuk olana doğru yönlendirilir. Sıcaklığı düşük bir cisimden sıcaklığı daha yüksek olan bir cisme kendiliğinden ısı transferi asla gerçekleşmez. Sonuç olarak, sonlu bir sıcaklık farkındaki ısı transfer süreci geri döndürülemez. Tersinir süreçler, bir sistemin bir denge durumundan diğerine geçiş süreçleridir ve aynı ara denge durumları dizisi aracılığıyla ters yönde gerçekleştirilebilir. Bu durumda sistemin kendisi ve etrafındaki cisimler orijinal hallerine geri döner. Sistemin her zaman denge durumunda kaldığı süreçlere yarı statik denir. Tüm yarı statik süreçler tersine çevrilebilir. Tersine çevrilebilen tüm süreçler yarı statiktir.
 Termal süreçlerin geri döndürülemezliği. Termodinamiğin ikinci yasası. Mekanik işi bir vücudun iç enerjisine dönüştürme işlemleri, sürtünmenin varlığı, gazlarda ve sıvılarda difüzyon işlemleri, ilk basınç farkı varlığında gaz karıştırma işlemleri vb. nedeniyle geri döndürülemez. Tüm gerçek işlemler geri döndürülemez, ancak geri dönüşümlü, keyfi olarak yakın süreçlere yaklaşabilirler. Tersine çevrilebilir süreçler gerçek süreçlerin idealleştirilmesidir. Termodinamiğin birinci yasası, tersinir süreçleri geri dönüşü olmayanlardan ayıramaz. Sadece termodinamik bir süreçten belirli bir enerji dengesi gerektirir ve böyle bir sürecin mümkün olup olmadığı hakkında hiçbir şey söylemez.
Termal süreçlerin geri döndürülemezliği. Termodinamiğin ikinci yasası. Mekanik işi bir vücudun iç enerjisine dönüştürme işlemleri, sürtünmenin varlığı, gazlarda ve sıvılarda difüzyon işlemleri, ilk basınç farkı varlığında gaz karıştırma işlemleri vb. nedeniyle geri döndürülemez. Tüm gerçek işlemler geri döndürülemez, ancak geri dönüşümlü, keyfi olarak yakın süreçlere yaklaşabilirler. Tersine çevrilebilir süreçler gerçek süreçlerin idealleştirilmesidir. Termodinamiğin birinci yasası, tersinir süreçleri geri dönüşü olmayanlardan ayıramaz. Sadece termodinamik bir süreçten belirli bir enerji dengesi gerektirir ve böyle bir sürecin mümkün olup olmadığı hakkında hiçbir şey söylemez.
 Termal süreçlerin geri döndürülemezliği. Termodinamiğin ikinci yasası. Kendiliğinden oluşan süreçlerin yönü termodinamiğin ikinci yasasıyla belirlenir. Termodinamikte belirli termodinamik süreç türlerinin yasaklanması şeklinde formüle edilebilir. İngiliz fizikçi W. Kelvin, 1851'de ikinci yasanın aşağıdaki formülasyonunu verdi: ikinci yasa Döngüsel olarak çalışan bir ısı motorunda, bir süreç imkansızdır, bunun tek sonucu, alınan tüm ısı miktarının mekanik işe dönüştürülmesi olacaktır. tek bir ısı deposundan.
Termal süreçlerin geri döndürülemezliği. Termodinamiğin ikinci yasası. Kendiliğinden oluşan süreçlerin yönü termodinamiğin ikinci yasasıyla belirlenir. Termodinamikte belirli termodinamik süreç türlerinin yasaklanması şeklinde formüle edilebilir. İngiliz fizikçi W. Kelvin, 1851'de ikinci yasanın aşağıdaki formülasyonunu verdi: ikinci yasa Döngüsel olarak çalışan bir ısı motorunda, bir süreç imkansızdır, bunun tek sonucu, alınan tüm ısı miktarının mekanik işe dönüştürülmesi olacaktır. tek bir ısı deposundan.
 Termal süreçlerin geri döndürülemezliği. Termodinamiğin ikinci yasası. Alman fizikçi R. Clausius, termodinamiğin ikinci yasasının başka bir formülasyonunu verdi: Tek sonucu, düşük sıcaklıktaki bir cisimden daha yüksek sıcaklıktaki bir cisime ısı alışverişi yoluyla enerjinin aktarılması olan bir süreç imkansızdır. Şek. Termodinamiğin ikinci yasası tarafından yasaklanan ancak birinci yasası tarafından yasaklanmayan süreçler gösterilmektedir. Bu süreçler termodinamiğin ikinci yasasının iki formülasyonuna karşılık gelir. 1 - ikinci türden sürekli hareket makinesi; 2 – soğuk bir gövdeden daha sıcak olana kendiliğinden ısı transferi (ideal soğutma makinesi)
Termal süreçlerin geri döndürülemezliği. Termodinamiğin ikinci yasası. Alman fizikçi R. Clausius, termodinamiğin ikinci yasasının başka bir formülasyonunu verdi: Tek sonucu, düşük sıcaklıktaki bir cisimden daha yüksek sıcaklıktaki bir cisime ısı alışverişi yoluyla enerjinin aktarılması olan bir süreç imkansızdır. Şek. Termodinamiğin ikinci yasası tarafından yasaklanan ancak birinci yasası tarafından yasaklanmayan süreçler gösterilmektedir. Bu süreçler termodinamiğin ikinci yasasının iki formülasyonuna karşılık gelir. 1 - ikinci türden sürekli hareket makinesi; 2 – soğuk bir gövdeden daha sıcak olana kendiliğinden ısı transferi (ideal soğutma makinesi)
MOLEKÜLER FİZİĞİN VE TERMODİNAMİĞİN TEMELLERİ
İstatistiksel ve diğer araştırma yöntemleri .
Moleküler fizik ve termodinamik, cisimlerde bulunan çok sayıda atom ve molekülle ilişkili makroskobik süreçleri inceleyen fizik dallarıdır.
Moleküler fizik Moleküler kinetik kavramlara dayanarak maddelerin yapısını ve özelliklerini inceleyen bir fizik dalıdır. Bu fikirlere göre:
1. Herhangi bir cisim - katı, sıvı veya gaz - çok sayıda çok küçük izole parçacık molekülünden oluşur.
2. Herhangi bir maddenin molekülleri sonsuz kaotik hareket halindedir (örneğin Brown hareketi).
3. İdealleştirilmiş bir ideal gaz modeli kullanılır; buna göre:
A). Gaz moleküllerinin gerçek hacmi, kabın hacmiyle karşılaştırıldığında ihmal edilebilir düzeydedir (nadirleşme).
B). Moleküller arasında etkileşim kuvvetleri yoktur.
V). Gaz moleküllerinin birbirleriyle ve kabın duvarlarıyla çarpışması kesinlikle elastiktir.
4. Cisimlerin makroskobik özellikleri (basınç, sıcaklık vb.), ana konsepti istatistiksel bir topluluk olan istatistiksel yöntemler kullanılarak tanımlanır; Çok sayıda parçacığın davranışı, tek bir parçacığın değil, tüm topluluğun ortalama özelliklerinin (ortalama hız, enerji) eklenmesiyle tanımlanır.
Termodinamik, moleküler kinetik teorinin aksine, cisimlerin makroskopik özelliklerini, onların makroskopik resimleriyle ilgilenmeden inceler.
Termodinamik- inceleyen fizik dalı genel özellikler Termodinamik denge durumundaki makroskobik sistemler ve bu durumlar arasındaki geçiş süreçleri.
Termodinamik, çok sayıda deneysel gerçeğin genelleştirilmesine dayanarak oluşturulan, termodinamiğin ilkeleri adı verilen 3 temel yasaya dayanmaktadır.
Moleküler kinetik teori ve termodinamik birbirini tamamlayarak tek bir bütün oluşturur, ancak çeşitli araştırma yöntemlerinde farklılık gösterir.
Termodinamik sistem, hem kendi aralarında hem de diğer cisimlerle etkileşime giren ve enerji alışverişinde bulunan bir dizi makroskobik cisimdir. Sistemin durumu termodinamik parametrelerle belirlenir - termodinamik sistemin özelliklerini karakterize eden bir dizi fiziksel büyüklük, genellikle durum parametreleri olarak sıcaklık, basınç ve spesifik hacim seçilir.
Sıcaklık - fiziksel miktar makroskobik bir sistemin termodinamik denge durumunu karakterize eder.
[T] = K - termodinamik ölçek, [ t] = °C - uluslararası pratik ölçek. Termodinamik ve m/n pratik sıcaklık arasındaki ilişki: T = t + 273, örneğin t = 20 °C'de T = 293 K.
Spesifik hacim, bir kütle biriminin hacmidir. Vücut homojen olduğunda, yani ρ = yapı o zaman homojen bir cismin makroskobik özellikleri cismin hacmini karakterize edebilir V.
İdeal gazların moleküler kinetik teorisi (m.k.t).
§1 İdeal gaz yasası .
Moleküler kinetik teori, ideal bir gazın idealleştirilmiş bir modelini kullanır.
İdeal gaz Molekülleri birbirleriyle uzaktan etkileşime girmeyen ve ihmal edilebilecek kadar küçük boyutlara sahip bir gazdır.
Gerçek gazlarda moleküller, moleküller arası etkileşim kuvvetlerini yaşarlar. Fakat H2, He, O2, N2 n'de. sen. (T=273K, P=1.01·10 5 Pa) yaklaşık olarak ideal bir gaz olarak kabul edilebilir.
Parametrelerden birinin ( p, V, T, S ) sabit kalır ve izoprosesler olarak adlandırılır.
- İzotermal süreç T= sabit, m = sabit , anlatılıyor Boyle-Mariotte yasası:
pV = sabit
- İzobarikişlem p = sabit açıklanan Gay-Lussac yasası
V = V0 (1+ at);
V = V 0 α T
Hacimsel genleşmenin termal katsayısı derece -1

- İzokorik süreç V = sabit
 Tanımlandı Charles'ın yasası
Tanımlandı Charles'ın yasası
p = p 0 (1+ a t);
p = p 0 α T
Hacmin sıcaklığa bağımlılığını karakterize eder.α 1 K ısıtıldığında bir gazın hacmindeki nispi değişime eşittir. Deneyimlerin gösterdiği gibi,tüm gazlar için aynıdır ve eşittir.
4. Maddenin mol'ü. Avogadro'nun numarası. Avogadro yasası.
Atom kütlesi ( ) kimyasal element bu elementin bir atomunun kütlesinin, karbon izotopu C 12'nin bir atomunun kütlesinin 1/12'sine oranıdır
Moleküler fizik. Termodinamik.
1.İstatistiksel ve termodinamik yöntemler
2.İdeal gazların moleküler-kinetik teorisi
2.1.Temel tanımlar
2.2.İdeal gazın deneysel yasaları
2.3.İdeal bir gazın durum denklemi (Clapeyron-Mendeleev denklemi)
2.4 İdeal bir gazın moleküler kinetik teorisinin temel denklemi.
2.5.Maxwell dağılımı
2.6 Boltzmann dağılımı
3.Termodinamik
3.1.İç enerji. Enerjinin serbestlik derecelerine göre düzgün dağılımı yasası
3.2.Termodinamiğin birinci yasası
3.3 Gazın hacmi değiştiğinde yaptığı iş
3.4 Isı kapasitesi
3.5.Termodinamiğin birinci yasası ve izoprosesler
3.5.1.İzokorik süreç (V = sabit)
3.5.2.İzobarik süreç (p = sabit)
3.5.3.İzotermal süreç (T = sabit)
3.5.4. Adyabatik süreç (dQ = 0)
3.5.5. Politropik süreçler
3.6.Dairesel süreç (döngü). Tersinir ve geri döndürülemez süreçler. Carnot döngüsü.
3.7.Termodinamiğin ikinci yasası
3.8 Gerçek gazlar
3.8.1.Moleküller arası etkileşim kuvvetleri
3.8.2.Van der Waals denklemi
3.8.3 Gerçek gazın iç enerjisi
3.8.4.Joule-Thomson etkisi. Gazların sıvılaştırılması.
1.İstatistiksel ve termodinamik yöntemler
Moleküler fizik ve termodinamik - okudukları fizik dallarımakroskobik süreçler cisimlerde bulunan çok sayıda atom ve molekülle ilişkilidir. Bu süreçleri incelemek için temelde farklı (ancak birbirini tamamlayan) iki yöntem kullanılır: istatistiksel (moleküler kinetik) Vetermodinamik.
Moleküler fizik - Tüm cisimlerin sürekli kaotik hareket halindeki moleküllerden oluştuğu gerçeğine dayanarak, moleküler kinetik kavramlara dayanarak maddenin yapısını ve özelliklerini inceleyen bir fizik dalı. Moleküler fizik tarafından incelenen süreçler, çok sayıda molekülün birleşik etkisinin sonucudur.. Çok sayıda molekülün davranış yasaları kullanılarak inceleniristatistiksel yöntem özelliklerin olduğu gerçeğine dayanmaktadır.makroskobik sistem sistem parçacıklarının özellikleri, hareketlerinin özellikleri ve bu parçacıkların dinamik özelliklerinin (hız, enerji vb.) ortalama değerleri ile belirlenir.Örneğin bir cismin sıcaklığı, moleküllerinin kaotik hareketinin ortalama hızıyla belirlenir ve bir molekülün sıcaklığından söz edilemez.
Termodinamik - yer alan makroskobik sistemlerin genel özelliklerini inceleyen fizik dalıtermodinamik denge durumu ve bu durumlar arasındaki geçiş süreçleri. Termodinamik dikkate alınmıyor mikroişlemler Bu dönüşümlerin temelinde yatan ve Termodinamiğin iki prensibi - Deneysel olarak oluşturulan temel yasalar.
Fiziğin istatistiksel yöntemleri fizik ve kimyanın birçok dalında kullanılamazken, termodinamik yöntemler evrenseldir. Ancak istatistiksel yöntemler bir maddenin mikroskobik yapısını belirlemeyi mümkün kılarken, termodinamik yöntemler yalnızca makroskobik özellikler arasında bağlantı kurar. Moleküler kinetik teori ve termodinamik birbirini tamamlayarak tek bir bütün oluşturur ancak araştırma yöntemlerinde farklılık gösterir.
2.İdeal gazların moleküler-kinetik teorisi
2.1.Temel tanımlar
Moleküler kinetik teoride çalışmanın amacı gazdır. Buna inanılıyor Rastgele hareketler gerçekleştiren gaz molekülleri, etkileşim kuvvetlerine bağlı değildir ve bu nedenle serbestçe hareket ederler, çarpışmalar sonucunda her yöne dağılma eğilimi gösterirler ve kendilerine sağlanan tüm hacmi doldururlar. Böylece gaz, gazın kapladığı kabın hacmini alır.
İdeal gaz aşağıdaki özelliklere sahip bir gazdır: moleküllerinin gerçek hacmi, kabın hacmiyle karşılaştırıldığında ihmal edilebilir düzeydedir; gaz molekülleri arasında etkileşim kuvveti yoktur; Gaz moleküllerinin birbirleriyle ve kabın duvarlarıyla çarpışmaları kesinlikle elastiktir. Birçok gerçek gaz için ideal gaz modeli, onların makro özelliklerini iyi bir şekilde tanımlar.
Termodinamik sistem - hem kendi aralarında hem de diğer cisimlerle (dış çevre) etkileşime giren ve enerji alışverişinde bulunan bir dizi makroskobik cisim.
Sistem Durumu- bir dizi fiziksel büyüklük (termodinamik parametreler, durum parametreleri) Bir termodinamik sistemin özelliklerini karakterize eden:sıcaklık, basınç, özgül hacim.
Sıcaklık- makroskobik bir sistemin termodinamik denge durumunu karakterize eden fiziksel bir miktar. SI sistemi kullanıma izin verir termodinamik Ve pratik sıcaklık ölçeği .Termodinamik ölçekte suyun üçlü noktası (609 Pa basınçta buz, su ve buharın termodinamik dengede olduğu sıcaklık) şuna eşit olarak kabul edilir: T = 273,16 Kelvin derece[K]. Pratik bir ölçekte, 101300 Pa basınçta suyun donma ve kaynama sıcaklıkları sırasıyla t = 0 ve t = 100 santigrat derece olarak eşit kabul edilir. [C].Bu sıcaklıklar birbirleriyle ilişkiyle ilişkilidir.
T = 0 K sıcaklığına sıfır Kelvin denir; modern fikirlere göre, bu sıcaklığa istenilen kadar yaklaşmak mümkün olsa da ulaşılamaz.
Basınç - normal kuvvet tarafından belirlenen fiziksel miktar F gazın (sıvının) içindeki tek bir alana gazın (sıvının) yanından etki eden, p = F/S, burada S sahanın boyutudur. Basınç birimi paskaldır [Pa]: 1 Pa, 1 m2'lik bir alana sahip kendisine normal bir yüzey üzerinde eşit olarak dağıtılan 1 N'lik bir kuvvet tarafından oluşturulan basınca eşittir (1 Pa = 1 N/m) 2).
Spesifik hacimbirim kütle başına hacimdir v = V/m = 1/r, burada V, m kütlesinin hacmidir, r ise homojen bir cismin yoğunluğudur. Homojen bir v ~ V cismi için homojen bir cismin makroskopik özellikleri hem v hem de V ile karakterize edilebilir.
Termodinamik süreç - Bir termodinamik sistemdeki, termodinamik parametrelerden en az birinde değişikliğe yol açan herhangi bir değişiklik.Termodinamik denge- termodinamik parametrelerinin zamanla değişmediği makroskobik bir sistemin durumu.Denge süreçleri - Sonlu bir zaman periyodunda termodinamik parametrelerdeki değişimin sonsuz derecede küçük olacağı şekilde meydana gelen süreçler.
izoprosesler - bunlar ana durum parametrelerinden birinin sabit kaldığı denge süreçleridir.İzobarik süreç - sabit basınçta meydana gelen bir süreç (koordinatlarda) V,t o tasvir edildiizobar ). İzokorik süreç- sabit bir hacimde (koordinatlarda) meydana gelen bir süreç p,t o tasvir edildiizokor ). İzotermal süreç - sabit bir sıcaklıkta meydana gelen bir işlem (koordinatlarda) p,V o tasvir edildiizoterm ). Adyabatik süreçsistem ile çevre arasında ısı alışverişinin olmadığı bir süreçtir (koordinatlarda) p,V o tasvir edildiadyabatik ).
Avogadro sabiti (sayı) - bir moldeki molekül sayısı NA =6,022. 10 23 .
Normal koşullar: p = 101300 Pa, T = 273,16 K.

